 |
|
Модель 1.1.
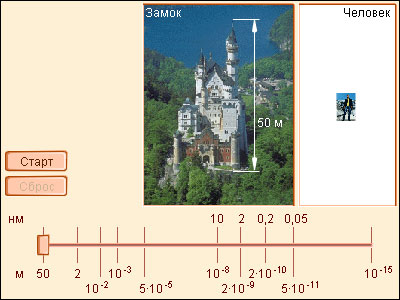
Размеры атомов и молекул
|

Химия изучает свойства веществ и закономерности процессов, сопровождающихся изменениями их структуры и состава.
Объектами изучения в химии служат: атомы, ионы, молекулы, радикалы, растворы, коллоидные и дисперсные частицы, кристаллические, стеклообразные и полимерные системы, координационные и кластерные соединения.
Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая все свойства, определенные зарядом ядра и электронной оболочкой. Составная часть вещества, содержащая одинаковые атомы, называется химическим элементом.

 |
|
Модель 1.1.
Размеры атомов и молекул
|
Атомный номер
Массовое число
Нуклиды – атомы с определенным числом протонов и нейтронов.
Изотопы – атомы с одинаковым
Изобары – атомы с одинаковым
Изотоны – атомы с одинаковым

 |
|
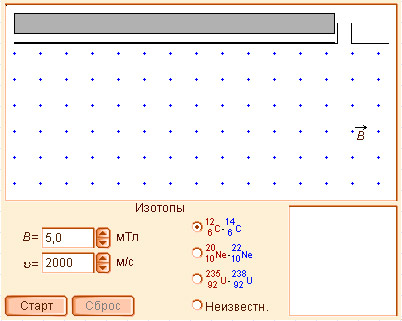
Модель 1.2.
Масс-спектрометр
|
Элемент обозначается установленным одно- или двухбуквенным символом. Левые индексы указывают массовое число
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таблица 1.1 Классификация нуклидов
|
Атомная масса – масса атома в атомных единицах массы (а. е. м.). За единицу а. е. м. принята 1/12 массы изотопа углерод-12.
Относительная атомная масса (безразмерная величина)
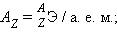 она численно равна атомной массе элемента.
она численно равна атомной массе элемента.
Относительная атомная масса элемента с учетом его изотопного состава равна
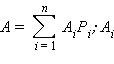 – относительная атомная масса изотопа,
– относительная атомная масса изотопа, 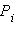 – доля каждого из изотопов элемента в земной коре.
– доля каждого из изотопов элемента в земной коре.

 |

