

 |
 |
Систематическое название неорганического соединения читается справа налево по изображенной формуле, записанной по определенным правилам, согласно которым на первое место всегда ставится электроположительная, а на второе – электроотрицательная составляющая.
В бинарных соединениях неметаллов на первое место ставится тот элемент, символ которого стоит раньше в следующем ряду:
| Rn, Xe, Kr, B, Si, C, Sb, As, P, N, H, Te, Se, S, At, I, Br, Cl, O, F; |
например, XeF4, NH3, H2O, Cl2O, OF2, IF7, SO2, NO, B2O3.
В соединениях металлов друг с другом (интерметаллидах) символы элементов указываются в порядке роста электроотрицательности: FeNi3, MgZn, Al4Cu9.
Количество одинаковых атомов или атомных групп в формуле указывается арабскими цифрами в виде правого нижнего индекса в круглых, квадратных или фигурных *) скобках; нормальный порядок для скобок – {[( )]}:
| Cr2(SO4)3, Ca3(PO4)2, La2(C2O4)3, [Cr(H2O)6]Cl3. |
В кристаллогидратах число молекул воды указывается арабскими цифрами:
| La2(C2O4)3∙10H2O, Na2SO4∙10H2O, CuSO4∙5H2O. |
Фигурные скобки обычно используются в формулах координационных соединений, поскольку комплексный ион или нейтральное координационное соединение непременно заключается в квадратные скобки; рекомендуемый порядок скобок [( )], [{( )}], [{[( )]}], например,
| [Co(NH3)6]Cl3, [Zn{NH2–CH2CH(NH2)CH2NH2}2]SO4. |
Одноатомные катионы называют по русскому названию элемента в родительном падеже и указанием степени окисления в скобках в виде арабской (
Указание степени окисления опускают, если возможен только один катион: K+ – катион калия, Ba2+ – катион бария.
Сложные катионы, образованные присоединением протона к нейтральной молекуле, называются с прибавлением окончания «-оний» или «-ий»: 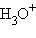 – катион оксония (оксоний),
– катион оксония (оксоний), 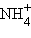 – катион аммония (аммоний),
– катион аммония (аммоний),  – катион пиридиния (пиридиний).
– катион пиридиния (пиридиний).
Сложные катионы многозарядных ионов металлов, содержащие кислород, называются с прибавлением окончания «-ил» к корню русского названия элемента: 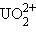 – уранил,
– уранил, 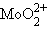 – молибденил,
– молибденил, 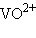 – ванадил.
– ванадил.
Анионы, состоящие из одного атома или нескольких одинаковых атомов, называют по элементу с окончанием «-ид»: – гидрид,
– гидрид, 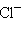 – хлорид,
– хлорид, 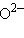 – оксид,
– оксид, 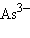 – арсенид,
– арсенид, 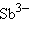 – антимонид,
– антимонид, 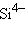 – силицид,
– силицид, 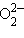 – пероксид,
– пероксид, 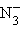 – азид.
– азид.
Некоторые многоатомные анионы имеют собственное название: 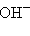 – гидроксид,
– гидроксид,
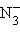 – азид,
– азид, 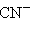 – цианид,
– цианид, 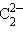 – ацетиленид.
– ацетиленид.
Сложные гетероатомные анионы элементов в высшей степени окисления оканчивается на «-ат» (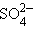 – сульфат,
– сульфат, 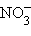 – нитрат,
– нитрат, 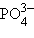 – фосфат); окончание «-ит» указывает на более низкую степень окисления (
– фосфат); окончание «-ит» указывает на более низкую степень окисления (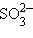 – сульфит,
– сульфит, 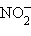 – нитрит,
– нитрит, 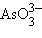 – арсенит).
– арсенит).
Название соли начинается с аниона в именительном падеже с соответсвующим окончанием (-ид, -ат, -ит) и катиона в родительном падеже (NaCl – хлорид натрия, MgSO4 – сульфат магния, AgNO3 – нитрат серебра).
Неорганические соединения с полиатомными анионами называют по правилам координационных соединений. При этом характеристический (центральный) атом координирует оксо- или другие ионы, а анион всегда оканчивается на -ат независимо от степени окисления характеристического атома: MgSO4 – тетраоксосульфат магния, AgNO3 – триоксонитрат серебра, Na2S2O3 – триоксодисульфат динатрия, Na3PO4 – тетраоксофосфат тринатрия.
 |
 |
 |

