

 Задачи с решениями
Задачи с решениями

При термическом разложении 10,0 г оранжевого кристаллического вещества получено 6,03 г Cr2O3, 2,86 г H2O и 0,89 л N2 при нормальных условиях. Установить эмпирическую формулу этого соединения.
Решение0,89 л 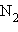 при нормальных условиях весит
при нормальных условиях весит 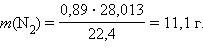
Найдем содержание всех составляющих это соединение элементов:
Для хрома
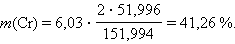 |
азота
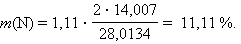 |
Для водорода
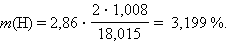 |
Для кислорода
Это составляет молей:
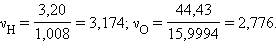
Найдем число атомов в веществе, поделив число молей на наименьшую величину: νCr = 1; νN = 1; νH = 4; νO= 3,5.
Поскольку атомов в формульной единице должно быть целое число, умножим их на два. Таким образом, эмпирическая формула соединения будет H4N2O7Cr. Этому составу соответствует бихромат аммония (NH4)2Cr2O7 (гептаоксодихромат диамония).
 3 из 15
3 из 15
 |