

 |
 |
Открытие радиоактивности связывают с именем А. Беккереля, который в 1896 г. обнаружил самопроизвольное испускание ураном ранее неизвестного излучения. Термин радиоактивность (лат. radio – излучаю, activus – действенный) был предположен в 1898 г. М. Кюри. В последующие два года работами Э. Резерфорда было установлено, что это излучение состоит из трех видов – положительно заряженных α-лучей, отрицательно заряженных β-лучей и незаряженных γ-лучей, которые вскоре были идентифицированы соответственно как пучки ядер гелия 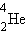 (α-лучи), пучки электронов (β-лучи) и электромагнитное излучение (фотоны) с частотами, значительно превышающими частоты рентгеновского излучения (γ-лучи). Испускание α- и β-лучей сопровождается превращением химических элементов:
(α-лучи), пучки электронов (β-лучи) и электромагнитное излучение (фотоны) с частотами, значительно превышающими частоты рентгеновского излучения (γ-лучи). Испускание α- и β-лучей сопровождается превращением химических элементов:
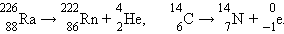 |
Кроме основного β-распада известны еще два его варианта – испускание позитрона 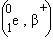
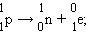 |
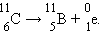 |
Электронный захват обусловлен захватом электрона из электронной оболочки атома протоном:
|
 |
Кроме природных (естественных) радиоактивных изотопов 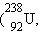
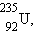
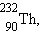
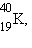
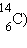 , начиная с 1934 года получено более 1200 искусственных изотопов. Супруги Ирен и Фредерик Жолио-Кюри получили первые искусственные изотопы
, начиная с 1934 года получено более 1200 искусственных изотопов. Супруги Ирен и Фредерик Жолио-Кюри получили первые искусственные изотопы 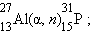
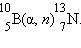
Устойчивость атомного ядра зависит от отношения числа нейтронов к числу протонов, а также четности или нечетности их числа, при этом ядра с четными числами протонов и нейтронов, как правило, устойчивее ядер с нечетными числами нуклонов (табл. 11.1).
|
|||||||||||||||
| Таблица 11.1 Число устойчивых изотопов с разными числами нуклонов
|
На рис. 11.1 приведен пояс устойчивости атомных ядер. Видно, что с возрастанием атомного номера отношение числа протонов к числу нейтронов для устойчивых ядер возрастает. Большинство радиоактивных изотопов расположено вне пояса устойчивости.
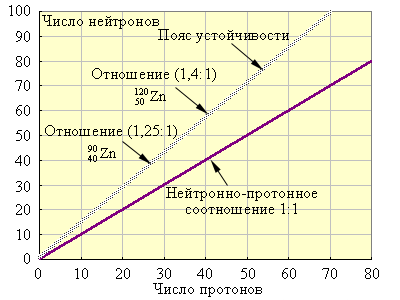 |
| Рисунок 11.1 Зависимость числа нейтронов от числа протонов в ядрах устойчивых изотопов
|
Ядра с числом протонов 84 и более неустойчивы. Ядра с числом нуклонов 2, 8, 20, 28, 50, 82, 126 более устойчивы, чем ядра элементов, расположенных рядом в периодической системе. Эти числа называют магическими.

 |
|
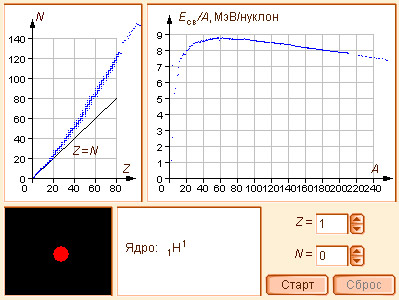
Модель 11.1.
Стабильность ядер
|
Спонтанное деление – еще один тип радиоактивного распада. Оно представляет собой самопроизвольный распад тяжелых ядер с
Радиоактивное превращение природных радиоактивных изотопов тяжелых элементов, начинающееся с одного родоначальника и заканчивающееся стабильным изотопом, объединены в так называемые радиоактивные ряды. Теоретически возможны четыре радиоактивных ядра с массовыми числами
*) Время жизни Земли оценивается в 4,5 млрд лет.
 |
| Рисунок 11.2 Счетчик Гейгера
|
Выше упоминалось, что все элементы тяжелее 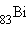 радиоактивны, все их изотопы претерпевают радиоактивный распад (
радиоактивны, все их изотопы претерпевают радиоактивный распад (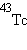 и
и 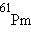 . В природной смеси изотопов следующих элементов содержатся радиоактивные изотопы:
. В природной смеси изотопов следующих элементов содержатся радиоактивные изотопы: 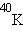 ,
, 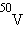 ,
, 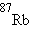 ,
, 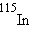 ,
, 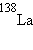 ,
, 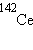 ,
, 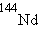 ,
, 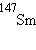 ,
, 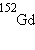 ,
, 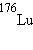 ,
, 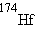 ,
, 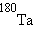 ,
, 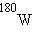 ,
, 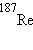 ,
, 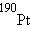 ,
, 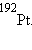 К ним следует добавить
К ним следует добавить 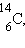 который образуется в атмосфере под действием космического излучения и всегда присутствует в живых организмах. После их гибели поступление углерода-14 прекращается и начинается его распад
который образуется в атмосфере под действием космического излучения и всегда присутствует в живых организмах. После их гибели поступление углерода-14 прекращается и начинается его распад
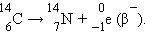 |
Радиоактивное излучение воздействует на вещество и, передавая веществу энергию, вызывает в нем электронное возбуждение, ионизацию и разрыв химических связей. Особенно опасно радиоактивное излучение для биологических объектов, поскольку оно может нарушить нормальное функционирование клеток, приводя к необратимым последствиям и даже к летальным исходам. Воздействие радиоактивного излучения на организм зависит от проникающей способности излучения. Из трех видов внешнего радиоактивного излучения наименьшей проникающей способностью обладает α-излучение, которое практически полностью поглощается кожным покровом. Бета-излучение способно проникать под кожный покров на глубину до 1 см. Попадание в организм носителей этих радиоактивных излучений весьма опасно. Наибольшую опасность представляет собой гамма-излучение, поскольку оно обладает весьма высокой проникающей способностью.
 |
 |
 |

