

 |
 |
Органическая химия изучает соединения, основу которых составляют атомы углерода, связанные между собой и многими элементами периодической системы простыми и кратными связями, способные образовывать линейные и разветвленные цепи, циклы, полициклы и др. Многообразие органических соединений во многом обусловлено изомерией – способностью некоторых соединений при одинаковом составе и массе различаться пространственным строением, физическими и химическими свойствами. Важное место в органической химии занимает номенклатура, позволяющая каждому соединению дать только ему присущее название, а по названию написать его структурное изображение (формулу). В основу номенклатуры органических соединений положены номенклатурные правила IUPAC – Международного союза по чистой и прикладной химии.
Современная органическая химия располагает сведениями о 10 млн органических соединений, количество которых ежегодно увеличивается на 250–300 тыс. наименований. Такое огромное количество органических веществ относится к сравнительно небольшому числу классов органических соединений, содержащих те или иные функциональные группы. Наличие этих функциональных групп и предопределяет характерные химические свойства данного класса соединений.
Органические соединения описывают с помощью молекулярных формул, представляющих собой линейную запись символов элементов в определенной последовательности с указанием числа атомов посредством численного индекса справа внизу. Структурная формула определяет последовательность атомов в молекуле с учетом структурной изомерии (скелетной, положения, цепь–цикл, функциональной).
Скелетная изомерия отражает строение углеводородной цепи (скелета):
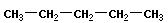 |
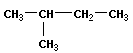 |
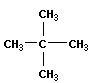 |
||
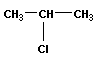
Изомерия положения отражает расположение кратной связи или функциональной группы:
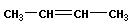 |
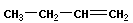 |
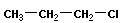 |
 |
|||
Изомерия цепь–цикл отражает образование изомеров в ненасыщенных углеводородах в результате образования моноциклических углеводородов.
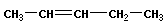 |
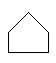 |
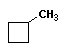 |
||
Функциональная изомерия отражает изомеры с различными функциональными группами:
 |
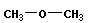 |
|
Эти виды изомерии относятся к пространственной изомерии, обусловленной разрывом и образованием такой же химической связи в другом месте молекулы (статическая стереохимия).
Пространственное расположение атомов в молекуле может измениться и без разрыва связей, а только в результате колебания или вращения атомов, связанных ординарными связями. Такие изменения называются конформационными, а наиболее устойчивые стереохимические формы – конформерами или ротамерами (динамическая стереохимия).
Проекционное изображение молекулы на плоскости передается посредством стереохимических формул. Условились, что связи, выступающие из плоскости, изображаются сплошным, а связи, уходящие за плоскость, – заштрихованным клином. Валентные связи, расположенные в плоскости, изображаются обычной чертой.
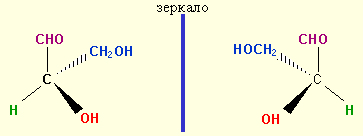
Глицериновый альдегид содержит атом углерода, связанный с четырьмя разными заместителями. Такой атом называют асимметричным или хиральным, поскольку подобно руке такая молекула может быть совмещена только со своим зеркальным отражением.
Два хиральных стереомера называются энантиомерами или оптическими изомерами. Стереоизомеры, не являющиеся энатиомерами, называются диастереомерами. Особенность энантиомеров заключается в их способности вращать плоскополяризованный свет на угол α в противоположных направлениях. Эквимолярная смесь обоих энантиомеров называется рацемической и оптически неактивна.
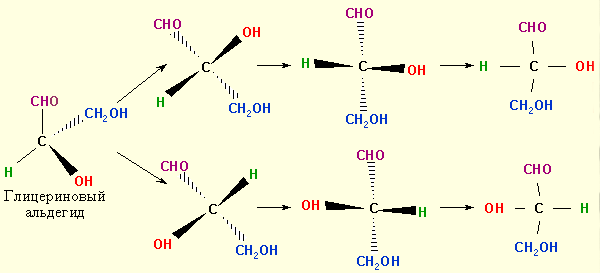
Для глицеринового альдегида возможны два энантиомера,
 |
| Рисунок 12.1 |
которые в проекциях Фишера изображаются так, чтобы заместители, связанные с асимметрическим атомом углерода и лежащие на двух вершинах тетраэдра, находящихся над плоскостью листа, были направлены вертикально, а заместители, находящиеся над плоскостью листа – слева и справа от него. При этом вверху располагается заместитель с наименьшим номером в ряду старшинства.
Старшинство заместителей определяется по следующим правилам:
Заместители располагаются в порядке уменьшения их массового числа (атомных номеров).
Сначала сравнивают заместители, непосредственно связанные с асимметричным центром (заместители первого ряда). При идентичности атомных номеров первого ряда сравнивают суммы атомных номеров второго, третьего и т. д. рядов, считая атом, связанный с другим двойной или тройной связью, дважды или трижды.
В глицериновом альдегиде старшинство заместителей уменьшается в ряду OH > CHO > CH2OH > H. В глицериновом альдегиде первый ряд атомов, связанных с C* (асимметрический углерод), содержит по одному атому кислорода и водорода и два атома углерода. Старшим из них будет кислород (8), младшим – водород (1). Во втором ряду у двух атомов углерода (8∙2) расположены: у одного водород и кислород, связанный с углеродом двойной связью, что в сумме составляет 17, а у другого – два водорода (1∙2) и кислород (8∙1), что в сумме составляет 10. Следовательно, стереометрические формулы глицеринового альдегида изображаются следующим образом:
 |
| Рисунок 12.2 |
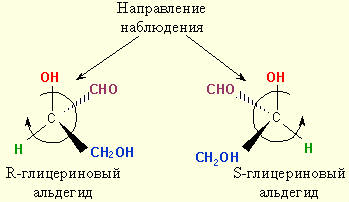
Для обозначения абсолютной конфигурации тетраэдр хирального атома располагают в пространстве таким образом, чтобы младший заместитель был направлен от наблюдателя, а три остальных заместителя были направлены в сторону наблюдателя. Если старшинство этих заместителей уменьшается по часовой стрелке (слево направо), то конфигурация асимметричного атома обозначают символом R (от латинского rectus – правый), если против часовой стрелки, то центр хиральности обозначают символом S (от латинского sinister – левый):
 |
| Рисунок 12.3 |
Органические соединения делятся на три класса: углеводороды, функциональные производные и гетероциклы.
Углеводороды состоят из углерода и водорода (см. рис. 12.4).
Функциональные производные содержат гетероатом(ы), не входящий(ие) в циклическую систему.
Гетероциклы – содержат в углеродном цикле один или несколько неуглеродных (гетеро) атомов.
 |
 |
 |

