

 |
 |
Атомный радиус. За радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус. При изучении строения молекул и кристаллов атомы и ионы можно рассматривать как имеющие некий эффективный радиус, зависящий от типа химической связи. Если рассматривать только относительные величины атомных радиусов, то легко обнаружить периодичность их зависимости от номера элемента.
В периодах орбитальные атомные радиусы по мере увеличения заряда ядра
В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек.
У
|
||||||
| Таблица 2.3 |
Эти элементы из-за близости их свойств называются элементами-близнецами.
Образование ионов приводит к изменению ионных радиусов по сравнению с атомными. При этом радиусы катионов всегда меньше, а радиусы анионов всегда больше соответствующих атомных радиусов. Ковалентный радиус равняется половине межатомного расстояния в молекулах или кристаллах простых веществ. Ионные радиусы элементов представлены в табл. 2.4.
Энергией ионизации атома
Энергия ионизации
Энергия ионизации определяет характер и прочность химической связи и восстановительные свойства элементов.
|
||||||||||||||||||||||||||||||||||||||||||||
| Таблица 2.5 Потенциалы (энергии) ионизации |
Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов (рис. 2.4).
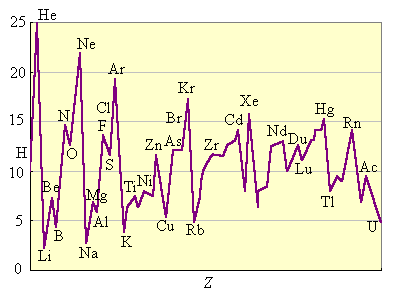 |
| Рисунок 2.4 Потенциалы ионизации нейтральных атомов
|
Энергия связи электрона с ядром пропорциональна
В главных подгруппах потенциалы ионизации с ростом
В побочных подгруппах
Чем меньше потенциал ионизации, тем легче атом отдает электрон. Поэтому восстановительная способность нейтральных атомов с ростом
Энергия сродства к электрону. Другой важной в химии характеристикой атома является энергия сродства к электрону – энергия, выделяющаяся при присоединении электрона к нейтральному атому. Чем больше электронное сродство, тем более сильным окислителем является данный элемент. Экспериментальное определение энергии сродства к электрону
|
||||||||||||||||||||||
| Таблица 2.6 Значение энергии сродства к электрону |
Немонотонность изменения сродства к электрону в периоде также обусловлена сравнительной устойчивостью полностью и наполовину заполненных подоболочек. Самый сильный из всех элементарных окислителей – фтор (он обладает и самым малым атомным радиусом из всех элементов VII группы).
Отметим, что в отличие от ионизации присоединение двух и более электронов энергетически затруднено, и многозарядные одноатомные отрицательные ионы в свободном состоянии не существуют.
Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями
В периодах электроотрицательность растет, а в группах уменьшается с ростом
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Таблица 2.7 Электроотрицательность элементов
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
В главных и побочных подгруппах свойства элементов меняются немонотонно, что обусловлено так называемой вторичной периодичностью, связанной с влиянием
Из анализа периодичности геометрических и энергетических параметров атомов следует, что периодическим законом можно пользоваться для определения физико-химических констант, предсказывать изменение радиусов, энергий ионизации и сродства к электрону, и, следовательно, кислотно-основные и окислительно-восстановительные свойства их соединений.
 |
 |
 |

