

 Вопрос для самопроверки
Вопрос для самопроверки
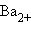 ( (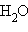 ) + ) + 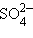 ( ( |
| β-белое | 0 | 51,55 |
| α-серое | –2092 | 44,14 |
 кристаллогидрата хлористого кальция в реакции
кристаллогидрата хлористого кальция в реакции 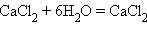 ∙
∙ 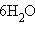 по следующим данным:
по следующим данным: 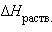 безводной соли
безводной соли 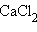 равна –72,84 кДж∙
равна –72,84 кДж∙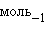 , а теплота растворения кристаллогидрата
, а теплота растворения кристаллогидрата 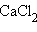 ∙
∙ 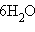 равна 18,03 кДж∙
равна 18,03 кДж∙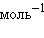 .
.| BaO(т) | CO2(г) | BaCO3(т) | |
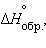 кДж∙моль–1 кДж∙моль–1 |
–554 | –393,8 | –1217 |
| 70 | 213,8 | 113 |
| FeO(т) + H2(г) = Fe(т) + H2O(г) |
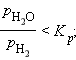 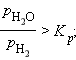 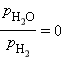 |
| MgO(т) + CO2(г) = MgCO3(т), |
| CO(т) + H2O(ж) = Ca(OH)2(т), |
| 2Na(т) + 2H2O(ж) = 2NaOH(т) + H2(г) |