Глава 4. Химическая термодинамика Задачи с решениями
Задачи с решениями

Энтальпии образования C2H5OH(г), CO2(г) и H2O(г) в стандартных условиях равны –235, –393,8 и –241,8 кДж∙моль–1 соответственно. Расчитайте ΔHсгор.C2H5OH(г).
Вычислите энтальпию сгорания C2H5OH(г), используя энергию связей (кДж∙моль–1): EC–H = 412; EC–C = 348; EC–O = 360; EO–H = 460; EO–O = 490; EC–O = 790. Сравните эту величину с величиной, расcчитанной с помощью
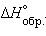
Решение
| |
C2H5OH(г) + 3O2(г) = 2CO2(г) + 3H2O(г).
|
|
| |
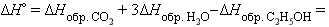 –2∙393,8 – 3∙241,8 + 235 = –1278 кДж∙моль–1. –2∙393,8 – 3∙241,8 + 235 = –1278 кДж∙моль–1.
|
|
| |
CH3CH2OH(г) + 3O2(г) = 2CO2(г) + 3H2O(г) |
|
| |
H–C–C–OH + 3O=O → 2O=C=O +3O
|
|
| |
ΔH° = 5EC–H + EC–C + EC–O + EO–H + 3EO=O – 4EC=O – 5EO–H = 5∙412 + 348 + 360 + 3∙490 – 4∙790 –5∙460 = 2060 + 348 + 360 + 1470 – 3160 – 2300 = –1222 кДж∙моль–1. |
|
Как видно значения ΔH°, расчитанные двумя методами, отличаются на 56 кДж∙моль–1, так как использование средних энергий связи для определения энтальпий реакций дает лишь приближенные значения последних.
 3 из 10
3 из 10
 |


 Задачи с решениями
Задачи с решениями

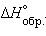
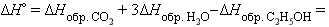 –2∙393,8 – 3∙241,8 + 235 = –1278 кДж∙моль–1.
–2∙393,8 – 3∙241,8 + 235 = –1278 кДж∙моль–1.
 3 из 10
3 из 10
