Глава 5. Химическая кинетика
5.6.2. Последовательные реакции
Последовательными называют реакции с промежуточными стадиями, когда продукт предыдущей стадии служит исходным веществом для последующей:
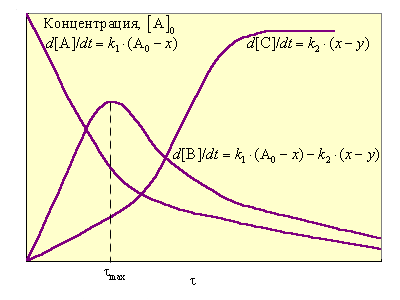
Зависимость концентраций реагентов этой двустадийной реакции приведена на рис. 5.6.
 1 1
|
| Рисунок 5.6 Изменение концентраций A, B и С для последовательной реакции A → B → C; x – концентрация A0, превратившегося в В, y – концентрация образовавшегося С
|
При k1 >> k2 все исходное вещество может превратиться в промежуточный продукт В, прежде чем начнется вторая реакция. Скорость всей реакции определяется второй стадией. При k1 << k2 концентрация промежуточного продукта мала, поскольку он не успевает накапливаться; эта стадия определяет скорость реакции в целом. Таким образом, скорость определяется самой медленной стадией (принцип лимитирующей стадии).