

 |
 |
p-Элементы имеют общую электронную конфигурацию
В подгруппе IIIА рассматривают отдельно B, Al и подгруппу галлия (Ga, In, Tl), в IVА – C, Si и подгруппу германия (Ge, Sn, Pb), в VА – N, P и подгруппу мышьяка (As, Sb, Bi), в VIА – O и подгруппу халькогенов (S, Se, Te, Po), в VIIА – галогены (F, Cl, Br, I, At), в VIIIА – Ne, Ar и подгруппу криптона (Kr, Xe, Rn).
 |
| Рисунок 8.3 Атмосфера Земли состоит, в основном, из молекул |
В отличие от
При переходе сверху вниз в подгруппах возрастает разница энергий s- и p-подуровней, поэтому легким элементам свойственны высшие степени окисления, тяжелым – низшие. Так, в подгруппе IVА стабильность соединений Э2+ возрастает в ряду Ge2+ < Sn2+ < Pb2+. В той же последовательности уменьшается устойчивость соединений Э4+. Подтверждением этому служит изменение термической устойчивости водородных соединений ЭH4.
|
||||||||||||
| Таблица 8.3 |
В табл. 8.5 приведены основные характеристики элементов IIIА–VIIА подгрупп.
Восстановительные свойства
|
||||||||||
| Таблица 8.4 |
и реакции типа
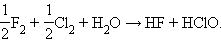 |
Окислителями и восстановителями являются соединения, в которых элементы находятся в неустойчивых степенях окисления и в ходе реакции переходят в более устойчивые. Так, для элементов IVА подгруппы стабильность степени окисления +2 увеличивается с ростом порядкового номера. Если Ge+2 – сильный восстановитель, то Pb+4 – энергичный окислитель.
Окислительная активность Pb+4 проявляется в реакции при разрядке свинцового аккумулятора
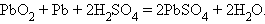 |
 |
 |
 |

