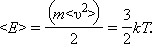Глава 5. Химическая кинетика

Модель 5.2.
Распределение Максвелла
Модель иллюстрирует тепловое движение молекул газа (молекулярный хаос). Предусмотрена возможность отмечать все молекулы, скорости которых попадают в некоторый выбранный интервал скоростей. На экране дисплея можно наблюдать кривые распределения молекул по скоростям для различных температур.
Молекулы газа вследствие теплового движения испытывают многочисленные соударения друг с другом. При каждом соударении скорости молекул изменяются как по величине, так и по направлению. В результате в сосуде, содержащем большое число молекул, устанавливается некоторое статистическое распределение молекул по скоростям, зависящее от абсолютной температуры T. При этом все направления векторов скоростей молекул оказываются равноправными (равновероятными), а величины скоростей подчиняются определенной закономерности. Распределение молекул газа по величине скоростей называется распределением Максвелла.
Если одновременно измерить скорости большого числа N молекул газа и выделить некоторый малый интервал скоростей от υ до υ + Δυ, то в выделенный интервал Δυ попадает некоторое число ΔN молекул. На графике удобно изображать зависимость величины 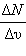 от скорости υ. При достаточно большом числе N эта зависимость изображается плавной кривой, имеющей максимум при
от скорости υ. При достаточно большом числе N эта зависимость изображается плавной кривой, имеющей максимум при 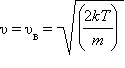 (наиболее вероятная скорость). Здесь m – масса молекулы, k = 1,38·10–23 Дж/К – постоянная Больцмана.
(наиболее вероятная скорость). Здесь m – масса молекулы, k = 1,38·10–23 Дж/К – постоянная Больцмана.
Характерным параметром распределения Максвелла является так называемая среднеквадратичная скорость υкв = <υ2>1/2, где <υ2> означает среднее значение квадрата скорости, которая равна
| |
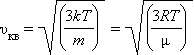 ,
,
|
|
где μ – молярная масса.
Из выражения для среднеквадратичной скорости следует, что средняя кинетическая энергия поступательного движения молекул газа есть
На экран выводится кривая распределения при заданной температуре и вычисляются среднеквадратичная υкв и наиболее вероятная υв скорости. Можно изменять температуру газа T и наблюдать смещение максимума кривой распределения. Все молекулы, скорости которых попали в выделенный интервал, окрашиваются в зеленый цвет. Среднюю скорость молекул, попавших в выделенный интервал, можно изменять, перемещая интервал по оси скоростей. Можно качественно наблюдать за количеством и скоростью движения окрашенных молекул. Обратите внимание, что количество зеленых молекул максимально, когда выделенный интервал скоростей располагается вблизи максимума кривой распределения. Скорость таких молекул совпадает с наиболее вероятной скоростью υв.




 Модель 5.2.
Распределение Максвелла
Модель 5.2.
Распределение Максвелла Модель 5.2.
Распределение Максвелла
Модель 5.2.
Распределение Максвелла
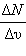 от скорости
от скорости 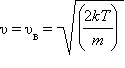 (наиболее вероятная скорость). Здесь
(наиболее вероятная скорость). Здесь 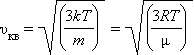 ,
,