Глава 4. Химическая термодинамика

Модель 4.2.
Адиабатический процесс
Моделируется процесс адиабатического сжатия и расширения идеального газа.
Адиабатический процесс – это процесс квазистатического расширения или сжатия газа в сосуде с теплонепроницаемыми стенками. Первый закон термодинамики для адиабатического процесса принимает вид
где ΔU – изменение внутренней энергии. В адиабатическом процессе газ совершает работу за счет изменения внутренней энергии. Внутренняя энергия идеального газа изменяется пропорционально его температуре. Для 1 моля одноатомного газа
Здесь 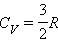 – молярная теплоемкость одноатомного газа при постоянном объеме.
– молярная теплоемкость одноатомного газа при постоянном объеме.
Молярная теплоемкость одноатомного газа при постоянном давлении 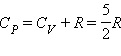 . На плоскости (P, V) адиабаты изображаются семейством кривых
PV γ = const. Это соотношение называют уравнением Пуассона. Здесь
. На плоскости (P, V) адиабаты изображаются семейством кривых
PV γ = const. Это соотношение называют уравнением Пуассона. Здесь 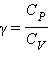 – показатель адиабаты. Для одноатомного газа
– показатель адиабаты. Для одноатомного газа 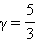 .
.
Работа газа в адиабатическом процессе просто выражается через температуры T1 и T2 начального и конечного состояний:
В модели можно изменять начальную температуру T газа. Приводится график зависимости P (V) для адиабатического процесса, выводится энергетическая диаграмма, на которой представлены производимая газом работа A и изменение ΔU его внутренней энергии.
С помощью этой энергетической диаграммы вы можете убедиться, что в адиабатическом процессе газ совершает работу (положительную или отрицательную) только за счет изменения его внутренней энергии. Это объясняется тем, что теплообмен с окружающими телами отсутствует.




 Модель 4.2.
Адиабатический процесс
Модель 4.2.
Адиабатический процесс Модель 4.2.
Адиабатический процесс
Модель 4.2.
Адиабатический процесс
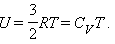
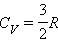 – молярная теплоемкость одноатомного газа при постоянном объеме.
– молярная теплоемкость одноатомного газа при постоянном объеме.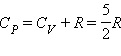 .
.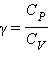
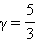 .
.


