 Модель 1.4.
Стехиометрические коэффициенты
Модель 1.4.
Стехиометрические коэффициенты Модель 1.4.
Стехиометрические коэффициенты
Модель 1.4.
Стехиометрические коэффициенты |
Эта модель поможет вам приобрести навыки в расстановке стехиометрических коэффициентов. На основании закона сохранения вещества вы установите, в каких соотношениях нужно взять исходные реагенты, чтобы завершить реакцию для получения конечных продуктов. Стехиометрические коэффициенты в уравнении расставлены правильно, если количество атомов каждого вида в левой и правой части уравнения одинаково.
Выберите уравнение реакции, для которого вы хотите подобрать коэффициенты. Для этого выделите строку с нужным уравнением в списке реакций, расположенном под окном с заданием. (В случае надобности вы можете прокрутить этот список вверх и вниз.) После этого выбранное вами уравнение появится в окне с заданием. Затем из списка, расположенного под списком уравнений, выберите тот член уравнения, коэффициент перед которым вы хотите изменить. Значение этого коэффициента следует установить при помощи поля ввода, расположенного правее списка членов уравнения. После того, как расстановка стехиометрических коэффициентов завершена, вы можете проверить правильность вашего решения, нажав на кнопку . Результат проверки вы увидите в небольшом окне, расположенном между окном с заданием и списком реакций.
Для примера разберем процесс расстановки коэффициентов в реакции BF3 + NaBH4 = NaBF4 + B2H6. Обратите внимание на атомы фтора. Для того, чтобы их количество в правой и левой части совпадало, коэффициент при BF3 и коэффициент при NaBF4 должны относиться как 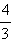 (*). Теперь посмотрим на атомы водорода. Чтобы их число в обеих частях совпадало, коэффициенты при NaBH4 и B2H6 должны относиться как 3/2 (**). При этом заметим, что коэффициент при NaBH4 должен быть равен коэффициенту при NaBF4 (***), чтобы уравнять количество атомов натрия в реагентах и продуктах. В результате мы можем взять коэффициент при BF3 взять равным 4, тогда условие (*) дает коэффициент при NaBF4 равный 3, условие (***) делает и коэффициент при NaBH4 равный 3, тогда по условию (**) перед B2H6 нужно поставить 2. Обратите внимание, что поскольку коэффициенты при всех продуктах и реагентах уже определены, количество атомов бора в левой и правой частях уравнялось автоматически.
Второй пример – окислительно-восстановительная реакция взаимодействия KMnO4 с HCl. (В нашей модели эта задача не предлагается для решения.) Исходные данные: в кислой среде
(*). Теперь посмотрим на атомы водорода. Чтобы их число в обеих частях совпадало, коэффициенты при NaBH4 и B2H6 должны относиться как 3/2 (**). При этом заметим, что коэффициент при NaBH4 должен быть равен коэффициенту при NaBF4 (***), чтобы уравнять количество атомов натрия в реагентах и продуктах. В результате мы можем взять коэффициент при BF3 взять равным 4, тогда условие (*) дает коэффициент при NaBF4 равный 3, условие (***) делает и коэффициент при NaBH4 равный 3, тогда по условию (**) перед B2H6 нужно поставить 2. Обратите внимание, что поскольку коэффициенты при всех продуктах и реагентах уже определены, количество атомов бора в левой и правой частях уравнялось автоматически.
Второй пример – окислительно-восстановительная реакция взаимодействия KMnO4 с HCl. (В нашей модели эта задача не предлагается для решения.) Исходные данные: в кислой среде 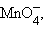 присоединяя 5 электронов, восстанавлявается до Mn2+, а Cl–, как восстановитель, теряя один электрон, окисляется до свободного хлора Cl2. В соответствии с этим запишем две полуреакции:
присоединяя 5 электронов, восстанавлявается до Mn2+, а Cl–, как восстановитель, теряя один электрон, окисляется до свободного хлора Cl2. В соответствии с этим запишем две полуреакции:
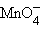 + 5e + 8
+ 5e + 8 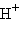 =
= 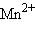 + 4
+ 4 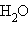
Коэффициенты в этих реакциях расставляем в соответствии с принципами, изложенными выше, учитывая, что полный электрический заряд в обеих частях полуреакции должен быть одинаков.
Число общих (принятых-отданных) электронов следует положить равным 10 (наименьшее общее кратное количеств электронов принятых в одной полуреакции и отданных в другой). В результате, домножая полуреакцию восстановления на 2, а полуреакцию окисления на 5 и складывая их, получим:
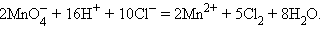 |
Условие электронейтральности каждого из веществ требует добавить в левую часть некоторое количество ионов калия и хлора, которые в продуктах дают KCl. Окончательно имеем:
| 2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 2KCl + 8H2O. |



