 Модель 4.3.
Изотермический процесс
Модель 4.3.
Изотермический процесс Модель 4.3.
Изотермический процесс
Модель 4.3.
Изотермический процесс |
Моделируется процесс изотермического сжатия и расширения идеального газа. Опыт можно проводить при различных температурах термостата. Текущие значения параметров газа выводятся на экран. Состояние газа указывается на графике в координатах (
Изотермический процесс – это процесс квазистатического расширения или сжатия вещества, находящегося в контакте с тепловым резервуаром,
На плоскости (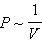 (закон Бойля–Мариотта). Для одного моля идеального газа:
(закон Бойля–Мариотта). Для одного моля идеального газа:
Так как внутренняя энергия идеального газа зависит только от температуры (закон Джоуля), то первый закон термодинамики для изотермического процесса записывается в виде:
Тепло
В модели можно выбирать температуру резервуара и проводить процесс при выбранной температуре. Приводится график зависимости
Из энергетической диаграммы видно, что в процессе изотермического расширения или сжатия внутренняя энергия идеального газа не изменяется, и полученное тепло полностью превращается в работу.



