 Модель 6.2.
Квантование электронных орбит
Модель 6.2.
Квантование электронных орбит Модель 6.2.
Квантование электронных орбит
Модель 6.2.
Квантование электронных орбит |
Третий постулат Н. Бора определяет правила квантования стационарных орбит. Бор предположил, что момент импульса электрона, вращающегося на стационарной орбите в атоме водорода, может принимать только дискретные значения, кратные постоянной Планка. Для круговых орбит правило квантования Бора записывается в виде:
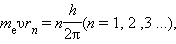 |
Правило квантования орбит по Бору получило наглядную интерпретацию в теории де Бройля, высказавшего гипотезу о наличии у электрона волновых свойств (1924 г.). Согласно де Бройлю электрону (и любому другому микрообъекту) соответствует волновой процесс с длиной волны
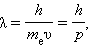 |
В применении к орбитальному движению электрона на стационарной круговой орбите в атоме водорода из правила квантования Бора вытекает соотношение
Это означает, что длина волны де Бройля целое число раз укладывается на длине стационарной круговой орбиты электрона, то есть стационарная орбита соответствует круговой стоячей волне де Бройля на длине орбиты.
Компьютерная модель является качественной иллюстрацией идеи де Бройля возникновения стоячих волн на стационарных орбитах.
Модель позволяет, плавно изменяя радиус, выбирать стационарные орбиты, на длине которых укладывается целое число длин волн де Бройля и образуется стоячая волна.
Компьютерная модель на примере орбит с квантовыми числами



