

 Задачи с решениями
Задачи с решениями

Для гальванического элемента, составленного из электродов:
| Pt | Ti3+, Ti2+ и Co2+ | Co, |
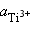 =
= 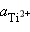 = 10–2 моль∙л–1,
= 10–2 моль∙л–1, 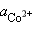 = 10–4 моль∙л–1.
Решение
= 10–4 моль∙л–1.
Решение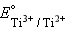 = –0,37 B, = –0,37 B, 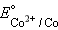 = –0,29 B = –0,29 B
|
| (–) Pt | Ti3+, Ti2+ || Co2+ | Co (+). |
Анодная реакция: 2Ti2+ – 2e– = 2Ti3+.
Катодная реакция: Co2+ + 2e– = Co.
Уравнение Нернста для суммарной реакции:
| Co2+ + 2Ti2+ = 2Ti3+ + Co |
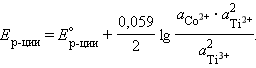 |
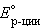 = = 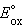 – – 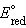 = –0,29 + 0,37 = 0,08 В. = –0,29 + 0,37 = 0,08 В.
|
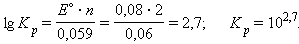 |
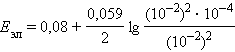 = 0,08 – 0,12 = –0,04 B. = 0,08 – 0,12 = –0,04 B.
|
| (–) Co2+ | Co || Ti3+, Ti2+ | Pt (+), |
| Co + 2Ti3+ = Co2+ + 2Ti2+. |
 2 из 5
2 из 5
 |