

 |
 |
По своим физическим свойствам и молекулярной структуре твердые тела разделяются на два класса – аморфные и кристаллические.
Характерной особенностью аморфных тел является их изотропность, т. е. независимость всех физических свойств (механических, оптических и т. д.) от направления внешнего воздействия. Молекулы и атомы в изотропных твердых телах располагаются хаотично, образуя лишь небольшие локальные группы, содержащие несколько частиц (ближний порядок). По своей структуре аморфные тела очень близки к жидкостям (см. §3.5). Примерами аморфных тел могут служить стекло, различные затвердевшие смолы (янтарь), пластики и т. д. Если аморфное тело нагревать, то оно постепенно размягчается, и переход в жидкое состояние занимает значительный интервал температур.
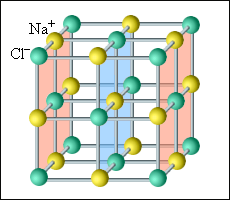
В кристаллических телах частицы располагаются в строгом порядке, образуя пространственные периодически повторяющиеся структуры во всем объеме тела. Для наглядного представления таких структур используются пространственные кристаллические решетки, в узлах которых располагаются центры атомов или молекул данного вещества. Чаще всего кристаллическая решетка строится из ионов (положительно и отрицательно заряженных) атомов, которые входят в состав молекулы данного вещества. Например, решетка поваренной соли содержит ионы Na+ и Cl–, не объединенные попарно в молекулы NaCl (рис. 3.6.1). Такие кристаллы называются ионными.
|
| Рисунок 3.6.1. Кристаллическая решетка поваренной соли |
В каждой пространственной решетке можно выделить структурный элемент минимального размера, который называется элементарной ячейкой. Вся кристаллическая решетка может быть построена путем параллельного переноса (трансляции) элементарной ячейки по некоторым направлениям.
Теоретически доказано, что всего может существовать 230 различных пространственных кристаллических структур. Большинство из них (но не все) обнаружены в природе или созданы искусственно.
Кристаллические решетки металлов часто имеют форму шестигранной призмы (цинк, магний), гранецентрированного куба (медь, золото) или объемно центрированного куба (железо).
Кристаллические тела могут быть монокристаллами и поликристаллами. Поликристаллические тела состоят из многих сросшихся между собой хаотически ориентированных маленьких кристалликов, которые называются кристаллитами. Большие монокристаллы редко встречаются в природе и технике. Чаще всего кристаллические твердые тела, в том числе и те, которые получаются искусственно, являются поликристаллами.
В отличие от монокристаллов, поликристаллические тела изотропны, т. е. их свойства одинаковы во всех направлениях. Поликристаллическое строение твердого тела можно обнаружить с помощью микроскопа, а иногда оно видно и невооруженным глазом (чугун).
Многие вещества могут существовать в нескольких кристаллических модификациях (фазах), отличающихся физическими свойствами. Это явление называется полиморфизмом. Переход из одной модификации в другую называется полиморфным переходом. Интересным и важным примером полиморфного перехода является превращение графита в алмаз. Этот переход при производстве искусственных алмазов осуществляется при давлениях 60–100 тысяч атмосфер и температурах
Структуры кристаллических решеток экспериментально изучаются с помощью дифракции рентгеновского излучения на монокристаллах или поликристаллических образцах.
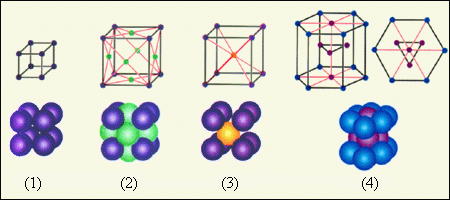
На рис. 3.6.2 приведены примеры простых кристаллических решеток. Следует помнить, что частицы в кристаллах плотно упакованы, так что расстояние между их центрами приблизительно равно размеру частиц. В изображении кристаллических решеток указывается только положение центров частиц.
|
| Рисунок 3.6.2. Простые кристаллические решетки: 1 – простая кубическая решетка; |
В простой кубической решетке частицы располагаются в вершинах куба. В гранецентрированной решетке частицы располагаются не только в вершинах куба, но и в центрах каждой его грани. Изображенная на рис. 3.6.1 решетка поваренной соли состоит из двух вложенных друг в друга гранецентрированных решеток, состоящих из Na+ и Cl–. В объемноцентрированной кубической решетке дополнительная частица располагается в центре каждой элементарной кубической ячейки.
Кристаллические структуры металлов имеют важную особенность. Положительно заряженные ионы металла, образующие кристаллическую решетку, удерживаются вблизи положений равновесия силами взаимодействия с «газом свободных электронов» (рис. 3.6.3). Электронный газ образуется за счет одного или нескольких электронов, отданных каждым атомом. Свободные электроны способны блуждать по всему объему кристалла.

|
| Рисунок 3.6.3. |
 |
 |
 |

