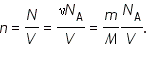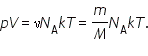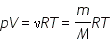|
Уравнение состояния идеального газа |  |
 |

|
Молекулярно-кинетическая теория рассматривает идеальный газ как множество частиц (молекул), расстояние между которыми намного превышает размеры самих частиц, находящихся в состоянии непрерывного хаотичного движения. Состояние идеального газа и процессы, проходящие в нем, будут определяться количеством частиц (молекул), из которых состоит газ, и их параметрами, такими как масса, диаметр, скорость, энергия и пр. Такие параметры называются микроскопическими или микропараметрами.
Однако состояние газов можно охарактеризовать немногим числом физических величин, относящимся не к каждой молекуле, а ко всему газу в целом. Такие параметры называются макроскопическими или макропараметрами. Если состояние газа не меняется, то не меняются и эти параметры. Поэтому температуру, объем, давление и некоторые другие параметры принято называть параметрами состояния газа. Из основного уравнения МКТ идеального газа можно получить уравнение состояния идеального газа, связывающее между собой параметры состояния Соотношение
связывающее давление газа с его температурой и концентрацией молекул, может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа — объемом
Здесь
Произведение постоянной Авогадро
Соотношение
называется уравнением состояния идеального газа.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном, в форме (*) оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона—Менделеева.
Следует отметить, что задолго до того, как уравнение состояния идеального газа было теоретически получено на основе молекулярно-кинетической модели, закономерности поведения газов в различных условиях были хорошо изучены экспериментально. Поэтому уравнение Клапейрона—Менделеева можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории. |