|
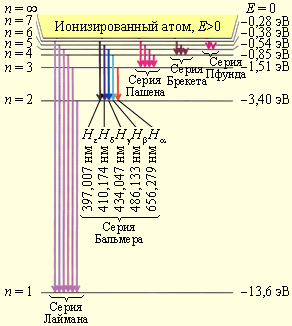
В 1913 году Нильс Бор предложил модель атома, которая объяснила существование линейчатых спектров у атомов. Это был атом Резерфорда, но в котором электрон может занимать только дискретные (стационарные) состояния, каждому из которых соответствует определенная энергия атома и приписывается главное квантовое число n. Излучение атома происходит при его переходе из состояния с большей энергией Ek в состояние с меньшей энергией En. Энергия кванта излучения определяется по формуле:
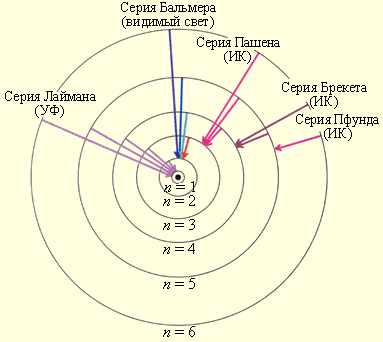
Набор всевозможных переходов и определяет линейчатый спектр атома данного сорта.
|
|
|
Рис. 1. Модель атома водорода по Бору. Стрелками указаны атомные переходы, соответствующие сериям Лаймана, Бальмера и другим в спектре водорода
|
Поглощение света соответствует переходу из состояния с меньшей энергией в состояние с большей энергией. Поэтому спектры излучения и поглощения атома совпадают.
|