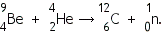|
Массовое и зарядовое числа |  |
 |

|
Ядро атома состоит из нуклонов: положительно заряженных протонов и незаряженных (электрически нейтральных) нейтронов. Массы протона и нейтрона близки и почти в 2000 раз превышают массу электрона. Таким образом, весь положительный заряд атома и практически вся его масса сосредоточена в ядре.
Для характеристики атомных ядер вводится ряд обозначений. Число протонов, входящих в состав атомного ядра, обозначают символом Общее число нуклонов (то есть протонов и нейтронов) называют массовым числом
Ядра химических элементов обозначают символом
Ядра одного и того же химического элемента могут отличаться числом нейтронов. Такие ядра называются изотопами (это слово образовано от двух греческих корней, в переводе означающих «одно» и «место»; все изотопы одного элемента находятся на одном и том же месте Периодической системы). У большинства химических элементов имеется несколько изотопов. Например, у водорода три изотопа:
При протекании ядерных реакций выполняется закон сохранения зарядового и массового чисел для ядер, вступающих в реакции, и продуктов реакции. Запишем для примера реакцию бомбардировки ядра бериллия альфа-частицей, в результате которой образуются нейтрон и ядро углерода:
Проверьте выполнение законов сохранения на примере этой реакции. |
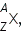 где X — химический символ элемента. Например,
где X — химический символ элемента. Например,
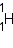 — водород,
— водород,
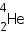 — гелий,
— гелий,
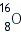 — кислород,
— кислород,
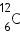 — углерод,
— углерод,
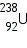 — уран.
— уран.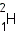 — дейтерий и
— дейтерий и 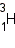 — тритий.
— тритий.