|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Вода абсолютно необходима для всех известных форм жизни – не случайно человеческое тело на 60–70 % состоит из воды. Вода выполняет в клетке и организме целый ряд важнейших функций.
У молекулы воды есть особые свойства, позволяющие ей выполнять функцию растворителя в клетке и организме. Она состоит из 2 атомов водорода, присоединенных к атому кислорода полярными ковалентными связями. У атома кислорода есть неподеленные электронные пары, к тому же он сильно оттягивает на себя электронную плотность, и на нем образуется частичный отрицательный заряд. На атомах же водорода образуется частичный положительный заряд. Между атомом водорода одной молекулы воды и атомом кислорода соседней возникает электростатическое притяжение, и каждая молекула воды образует с несколькими соседними водородные связи. Время существования этих связей невелико, они быстро разрушаются, но тут же вновь образуются уже с другими молекулами воды. Благодаря постоянному образованию таких связей вода имеет сравнительно высокие температуры плавления и кипения, а также плотность (для сравнения, сероводород H2S плавится при –86 °С и кипит при –61 °С, селенистый водород H2Se – при –64 °С и при –42 °С, соответственно, а теллуристый водород H2Te – при –48 °С и при –2 °С, соответственно).
Если насыпать в воду порошок какого-нибудь соединения с поляризованными связями, то между атомами этого вещества, несущими частичный положительный заряд, и атомами кислорода воды возникнет электростатическое притяжение; оно также возникнет между атомами водорода воды и атомами рассматриваемого вещества, несущими частично отрицательный заряд. Если молекулы данного вещества будут связываться с водой сильнее, чем друг с другом, то оно растворится (например, так будут вести себя кристаллы NaCl или сахарозы). Если же сильнее окажутся связи молекул вещества друг с другом, то порошок только намокнет в воде (например, толченое стекло). Если в воду поместить соединение с неполярными связями – допустим, угля, то молекулы воды с этим веществом взаимодействовать не будут. Им гораздо «выгоднее» образовать водородные связи друг с другом, такое вещество как бы вытеснится из воды и не будет растворяться. Если вещество жидкое, оно будет отделяться от воды (например, керосин). Соединения с неполярными ковалентными связями называются гидрофобными (от греч.
Вода выполняет и другие важные функции. Так, она непосредственно вступает во множество химических реакций – например, в пищеварительной системе происходит гидролиз (распад под действием воды) различных питательных веществ – белков, жиров, углеводов. В составе крови вода переносит тепло от мест его выработки ко всем частям тела. Благодаря высокой теплоемкости она поглощает избыток тепла, образующийся в ходе биохимических реакций, и не допускает перегрева организма. У воды большая удельная теплота испарения, и это свойство используется для охлаждения организма (запыхавшаяся собака высовывает язык как раз для того, чтобы испаряющаяся вода охлаждала его, а вместе с ним и все тело). Наконец, вода и растворенные в ней вещества создают тургорное давление. Живые организмы содержат множество разнообразных химических элементов. Так, взрослый человек массой 70 кг имеет следующий элементный состав:
Как видно из таблицы, содержание разных элементов в организме человека сильно отличается. Больше всего живой организм содержит кислорода, углерода, водорода и азота. Эти элементы содержатся в таких важнейших соединениях как углеводы, липиды, белки, нуклеиновые кислоты и др. а уже из водорода и кислорода состоит еще и вода. Много фосфора и кальция содержится в костях. Кальций играет также важнейшую роль в регуляции различных физиологических и биохимических процессов – мышечного сокращения, свертывания крови, клеточного деления и других. Фосфор входит в состав нуклеиновых кислот, нуклеотидов, а также различных богатых энергией соединений. Он также участвует в регуляции активности ферментов. Ионы натрия, калия и хлора участвуют в создании нужного осмотического давления в цитоплазме клеток и во внеклеточных жидкостях, в поддержании электрического потенциала на наружной мембране, в процессах возбуждения нервных и мышечных клетках. Сера входит в состав белков и некоторых структурных полисахаридов. Ионы магния, цинка и марганца необходимы для работы некоторых ферментов. В растительных клетках магний входит в состав пигмента хлорофилла. Ион железа Fe2+ является необходимым компонентом гемоглобина – белка, переносящего кислород в крови, а также миоглобина – белка, запасающего кислород в мышцах. Кроме того, ионы железа и меди входят в состав ферментов биологического окисления. Ион кобальта является необходимым компонентом витамина В12, который нужен для работы некоторых ферментов. Йод входит в состав гормонов щитовидной железы – тироксина и трийодтиронина. Концентрации многих ионов могут различаться внутри клеток и снаружи:
Различие внутриклеточных и внеклеточных концентраций ионов калия и хлора играет важнейшую роль в создании электрического заряда на мембране клетки – т. н. потенциала покоя. У всех живых эукариотических клеток на наружной стороне наружной мембраны имеется положительный заряд, а на внутренней – отрицательный. Эта разность потенциалов сильно различается у разных типов клеток: у нервных клеток и клеток поперечно-полосатых мышц она лежит в пределах 50–100 милливольт, у гладкомышечных клеток не превышает 30 мВ, а у фибробластов бывает еще меньше. Принято, что такое распределение зарядов соответствует отрицательному значению мембранного потенциала, т. е. в типичной нервной клетке человека мембранный потенциал равен –75 мВ. Для того чтобы понять, как возникает мембранный потенциал, представим себе, что клетка окружена полностью непроницаемой мембраной – «полиэтиленовым пакетом». Внутри клетки высокая концентрация катионов калия К+ и органических анионов А– – нуклеиновые кислоты и многие белки (см. уроки 5 и 7) в физиологических условиях представляют собой анионы. Снаружи клетки концентрация иона калия невелика, никаких нуклеиновых кислот там не имеется, а анионом, уравновешивающим заряд К+, служит Cl–. Никакого заряда на мембране нет: как внутри клетки, так и снаружи количество анионов строго равно количеству катионов, обе стороны мембраны электрически нейтральны. Теперь представим себе, что вместо полиэтиленового пакета клетка окружена нормальной наружной мембраной. Эта мембрана непроницаема для крупных молекул белков и нуклеиновых кислот, поэтому анионы A– не смогут выходить из клетки. Однако на этой мембране есть специальные белки – калиевые каналы, делающие ее проницаемыми для ионов K+. Куда он пойдет через эти каналы? Разумеется, с той стороны, где его много, в ту сторону, где его мало – то есть изнутри клетки наружу. Но будет ли это движение беспрепятственным? Нет, очень скоро ему начнет противодействовать электрическое поле: положительно заряженная частица выходит из клетки, а ее отрицательно заряженная пара A– остается в клетке. Значит, на мембране появится электрический потенциал, и чем больше выйдет ионов К+, тем выше будет мембранный потенциал, тем сильнее он будет мешать дальнейшему выходу этого катиона. Вскоре наступит равновесие: некоторая часть ионов К+ выйдет из клетки и зарядит мембрану настолько, что электрическое поле воспрепятствует дальнейшему выходу этого иона.
Избыток ионов K+, вышедших из клетки для создания мембранного потенциала, очень невелик. Представьте себе два маленьких участка, вплотную прилегающих к наружной мембране с разных сторон – два кубика со стороной 10 нанометров (т. е. 0,01 микрон). В том кубике, что прилегает к мембране снаружи, будет около 2000 ионов K+, а в том, что прилегает изнутри клетки, около 100 000 ионов K+. Так вот, для того, чтобы создать разность потенциалов –75 мВ, нужно, чтобы из клетки вышло всего 6 ионов калия, и там остались бы лишние 6 анионов A–. Нервные и мышечные клетки обладают свойством возбудимости – способностью резко изменять величину мембранного потенциала в ответ на определенные стимулы. У этих клеток мембранный потенциал в обычном, невозбужденном состоянии, называется потенциалом покоя, а его резкое скачкообразное изменение при возбуждении – потенциалом действия. В развитии процесса возбуждения важнейшую роль играют ионы натрия. В организме животных снаружи клеток много иона Na+. В состоянии покоя клеточная мембрана практически непроницаема для натрия, поэтому он не вносит существенного вклада в образование мембранного потенциала. Однако на мембране нервных и мышечных клеток есть особые белки – потенциал-зависимые натриевые каналы. Они обладают целым рядом интересных свойств. Пока мембранный потенциал достаточно отрицателен (–50 мв и еще ниже), эти каналы закрыты, через них не проходит ток. Но как только потенциал достигнет пороговой величины (у нервных клеток это –50 мв), эти каналы открываются. Внутрь клетки устремляется поток катионов Na+ – ведь снаружи их гораздо больше, чем внутри. Этот приток ионов натрия быстро вызовет деполяризацию мембраны, а потом и обратную поляризацию до +35 мВ. Но как только мембрана окажется обратно поляризована, каналы закроются. Более того, некоторое время они не смогут реагировать на новые раздражители – участок мембраны как бы «отдыхает». А ионы K+ будут выходить наружу: ведь снаружи их гораздо меньше, чем внутри, а мембранный потенциал еще далек от равновесного значения –75 мВ. По мере выхода K+ потенциал восстанавливается, и клетка возвращается в исходное состояние. Такой всплеск мембранного потенциала называется потенциалом действия, он и составляет нервный импульс. Его длительность составляет всего 1 миллисекунду в нервах, 10 мс в скелетных мышцах и 200 мс в сердечной мышце. Потенциал действия быстро распространяется по возбудимой клетке – в некоторых нейронах скорость передачи возбуждения составляет 120 м/с. Правда, по другим нейронам потенциал действия передается медленнее, до 0,5 м/сек (обратите внимание, если вы ударили босой ногой кирпич, то осязательный сигнал достигает мозга практически мгновенно, а вот болевой лишь спустя некоторое время).
Может возникнуть вопрос: при возбуждении в клетку вошло некоторое количество ионов Na+ и вышло некоторое количество K+. Значит, если через нейрон пройдет несколько десятков импульсов, то наружные и внутренние концентрации этих ионов сравняются, и нерв перестанет работать? Чтобы этого не случилось, на наружной мембране есть специальный белок, Na+/K+–АТФаза. Это ионный насос, который выкачивает из клетки ионы Na+ и закачивает внутрь ионы K+ (см. урок 9). Он позволяет восстановить ионный состав возбудимой клетки. Концентрации неорганических ионов могут различаться и в отдельных органеллах клетки. Так, в полости эндоплазматической сети концентрация иона кальция Са2+ очень высока – несколько миллимоль/л, тогда как в цитоплазме она очень низкая (примерно 0,01 микромоль/л). При возбуждении мышечной клетки на мембране эндоплазматической сети открываются специальные кальциевые каналы, этот ион выходит из этой органеллы в цитоплазму, где его концентрация резко повышается. Повышение концентрации Са2+ запускает процесс мышечного сокращения. Для протекания многих биохимических реакций очень важна кислотность среды, то есть концентрация ионов H+. Для ее оценки используют так называемый водородный показатель (его обозначают рН). рН = –lg [H+], где [H+] – это концентрация ионов H+. У нейтральных растворов рН = 7, у кислых рН < 7, а у щелочных рН > 7. Цитоплазма клетки имеет рН 7,2–7,4, это почти нейтральный раствор. В других органеллах рН может быть другой: так, в лизосомах среда кислая, а в матриксе митохондрий – щелочная. Клетка поддерживает кислотность среды различных органелл на постоянном уровне. Во многих физиологических жидкостях содержатся вещества, обладающие буферным действием – они препятствуют изменению рН. Буферным действием обладают, в частности, смеси диссоциированных и недиссоциированных форм слабых кислот при значениях рН близких –lg Рассмотрим, например, поведение раствора ацетата натрия и уксусной кислоты при рН около 5 (–lg Для изменения рН внутри органелл часто используются ферменты, активно транспортирующие ионы H+ через мембрану. Растворенные вещества перемещаются по объему клетки за счет случайного, хаотического перемещения молекул. Пассивное перемещение вещества из участка с большей концентрацией к участкам с меньшей концентрацией называется диффузией. Скорость диффузии частиц тем выше, чем меньше их размер. В среднем молекулы весом несколько сотен дальтон (1 дальтон = 1 а.е.м.) перемещаются на 10 микрометров (средний размер животной клетки) приблизительно за 0,1–0,2 секунды. Скорость диффузии крупных молекул (белков, нуклеиновых кислот) существенно меньше, но все же достаточна для нужд клетки. Еще более крупные образования – органеллы – таким способом перемещались бы слишком медленно, поэтому клетка использует специальные транспортные системы для их перемещения. Клеточные мембраны проницаемы для воды, но непроницаемы для многих внутриклеточных веществ. Если поместить клетку в чистую воду, то эти вещества не будут выходить из клетки, а вот вода станет в нее входить, поскольку ее концентрация в клетке ниже. Такая диффузия растворителя через мембрану, непроницаемую для растворенных веществ, называется осмосом. Из-за осмоса клетки человека не могут находиться в дистиллированной воде: она будет входить в клетку, клетка набухнет и быстро лопнет. Если же поместить клетки человека в раствор с высокой концентрацией солей, то вода будет выходить из них, и клетки сожмутся. Клетки растений и микробов имеют толстую клеточную стенку, которая позволяет им сохраниться в целости.
В организме человека осмотическое давление крови, а также концентрация важнейших ионов поддерживается на постоянном уровне. При значительной кровопотере больным необходимо срочно восстановить объем жидкости, циркулирующей в кровеносной системе. Если нет возможности сделать переливание крови от другого человека, то можно внутривенно ввести раствор, имеющий то же осмотическое давление, что и кровь. 0,9 % раствор поваренной соли – самый простой физиологический раствор, способный поддерживать жизнедеятельность организма. Краткое содержание урока
|




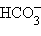
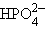
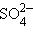
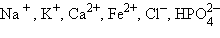 и др., концентрации этих ионов часто отличаются снаружи клетки и внутри. Перемещение молекул по клетке осуществляется путем диффузии.
и др., концентрации этих ионов часто отличаются снаружи клетки и внутри. Перемещение молекул по клетке осуществляется путем диффузии.