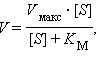|
|||||||||||||||||||||||||||||||
|
Ферменты – биологические катализаторы, почти все ферменты являются белками (хотя недавно выяснилось, что некоторые реакции катализируют РНК, а не белки). Вещества, участвующие в реакции, которую катализирует фермент, называются субстратами. От обычных катализаторов ферменты отличает несколько особенностей. Во-первых, ферменты обладают очень высокой специфичностью: они узнают такие небольшие отличия в структуре веществ, как наличие лишней –СН2-группы, умеют различать цис- и транс-изомеры, D- и L-изомеры. Некоторые ферменты, однако, обладают не очень строгой специфичностью – так, фермент желудочного сока пепсин расщепляет пептидные связи, образованные как ароматическими, так и кислыми аминокислотами (заметим, что для выполнения биологической функции пепсину и не нужна высокая специфичность: наоборот, чем больше разных пептидных связей он расщепит, тем лучше переварится пища в желудке). Во-вторых, ферменты обладают чрезвычайно высокой эффективностью, значительно превосходящей эффективность обычных катализаторов. Так, одна молекула фермента каталазы, ускоряющего разложение перекиси водорода на воду и кислород, успевает расщепить В-третьих, ферменты теряют свою активность при повышении температуры. Мы говорили в уроке 5, что при высоких температурах белки подвергаются денатурации: они теряют свою природную конформацию и уже не могут выполнять биологические функции. Наконец, в четвертых, многие (хотя и не все) ферменты подвергаются регуляции – в зависимости от нужд клетки и организма их активность может возрастать, а может и уменьшаться. Ферменты давно используются в медицине. Так, во многих клиниках проводят измерение активности различных форм ферментов лактатдегидрогеназы и трансаминазы – их соотношение изменяется при таких болезнях как инфаркт миокарда, поражения печени, мышечные дистрофии; фермент стрептокиназу врачи применяют для рассасывания тромбов; ферменты трипсин и коллагеназа используются для рассасывания рубцов. В биотехнологии ферменты применяются еще шире. Амилаза, расщепляющая крахмал, используется в пивоваренной, хлебопекарной (облегчает переработку крахмала дрожжами), текстильной и кожевенной промышленности (умягчает сырье). Различные протеазы, расщепляющие белки, применяют в пищевой (делают старое мясо более мягким, сворачивают молоко в сыроварении) и кожевенной промышленности. В пищевой промышленности используются инвертаза (расщепляет сахарозу), глюкоизомераза (изомеризует глюкозу в более сладкую фруктозу), трансглютаминаза (сшивает белки, улучшая структуру продукта), липазы (расщепляют липиды, применяются для получения более ценных пищевых жиров), пектинметилэстераза (осветляет фруктовые соки) и т. д. Протеазы и липазы часто добавляют в стиральные порошки для лучшего удаления грязи. Участок молекулы фермента, который непосредственно взаимодействует с субстратом, называется активным центром фермента. В активном центре можно выделить две области: субстрат-связывающий участок и каталитический участок. Субстрат-связывающий участок определяет специфичность узнавания ферментом своего субстрата, а каталитический непосредственно производит химическое превращение субстрата в продукт. В активном центре оказываются сближенными аминокислотные остатки, далеко удаленные друг от друга в первичной структуре. Активный центр занимает небольшую часть от всей белковой глобулы фермента, все остальные аминокислоты нужны для поддержания аминокислотных остатков активного центра в нужном положении.
Высокая специфичность ферментов объясняется тем, что субстрат подходит к их активному центру как ключ к замку.
В молекуле субстрата могут быть положительно и отрицательно заряженные группы, поляризованные группы с частичными зарядами, а также гидрофобные зоны. Соответственно, в субстрат-связывающем участке активного центра напротив положительно заряженных групп субстрата будут располагаться отрицательно заряженные группы фермента, напротив отрицательно заряженных – положительно заряженные, а напротив гидрофобных фрагментов субстрата – гидрофобные аминокислотные остатки. Таким образом, связывание фермента с субстратом происходит благодаря ионным, водородным и гидрофобным взаимодействиям. В настоящее время детально изучен механизм работы далеко не всех ферментов. Одним из наиболее изученных является фермент поджелудочной железы α-химотрипсин, расщепляющий белки пищи в двенадцатиперстной кишке и тонком кишечнике. Он гидролизует пептидные связи, расположенные около ароматических аминокислот субстрата. В каталитическом участке активного центра α-химотрипсина находятся три аминокислотных остатка: серин, гистидин и аспарагиновая кислота. В третичной структуре фермента они тесно прилегают друг другу, но в первичной структуре расположены далеко: гистидин является 57-й аминокислотой с N-конца, аспартат – 102-й, серин – 195-й.
В начале процесса катализа в активный центр фермента заходит субстрат, для нас важна одна-единственная пептидная связь в его молекуле (этап 1 на рисунке). Появление субстрата вызывает перемещение иона Н+ от серина на гистидин, а образовавшийся анион серина немедленно атакует карбонильный атом углерода в пептидной связи субстрата (этап 2 на рисунке). Образуется очень короткоживущее промежуточное соединение, в котором атом углерода субстрата связан с двумя атомами кислорода, одним атомом азота и одни атомом углерода. Это соединение быстро распадается, причем одна его половинка остается ковалентно связанной с остатком серина, а другая забирает ион Н+ от гистидина и становится полностью свободной (этап 3 на рисунке). Такое ковалентное соединение фермента с частью субстрата называется ацил-фермент. Затем часть субстрата со свободной аминогруппой уходит из активного центра (этап 4 на рисунке). Для завершения реакции необходимо гидролизовать ацил-фермент, и в активный центр химотрипсина приходит молекула воды (этап 5 на рисунке). Опять образуется короткоживущий промежуточный комплекс, в котором атом углерода субстрата связан с тремя атомами кислорода и одни атомом углерода (этап 6 на рисунке). Этот комплекс также быстро распадается, при этом ковалентная связь между остатком субстрата и фермента разрывается (этап 7 на рисунке). Наконец, остаток субстрата покидает активный центр фермента, и он возвращается в исходное состояние (этап 8 на рисунке). В результате реакция гидролиза пептидной связи протекает через множество промежуточных этапов. Без фермента реакция идет очень медленно, а каждая из промежуточных стадий, протекающих в активном центре фермента, идет быстро, в итоге фермент резко ускоряет протекание реакции. Скорость химической реакции – это изменение концентрации продукта в единицу времени. Еще в 1913 году Михаелис и Ментен вывели уравнение зависимости скорости простейшей ферментативной реакции
где
Скорость ферментативной реакции может быть замедлена специальными веществами – ингибиторами. Некоторые ингибиторы ферментов – смертельные яды для человека, тогда как другие являются ценными лекарствами. К таким лекарствам относятся, например, сульфаниламидные препараты. Многим видам болезнетворных бактерий для роста необходима пара-аминобензойная кислота H2N–C6H4–COOH. Они используют ее для синтеза более сложного соединения – фолиевой кислоты, важного витамина. Сульфаниламид H2N–C6H4–SO3H (бытовое название – стрептоцид) и его производные похожи на пара-аминобензойную кислоту, они связываются с ферментом, участвующим в синтезе фолиевой кислоты, занимая субстрат-связывающий участок активного центра. Но они не могут вступить в реакцию, которую катализирует фермент, а просто сидят в активном центре и не дают вступить в реакцию истинному субстрату – пара-аминобензойной кислоте. В результате бактерия не может синтезировать необходимый ей витамин. Человек не имеет этого фермента, он должен получать фолиевую кислоту с пищей, поэтому для человека сульфаниламидные препараты безвредны (однако они угнетают полезную микрофлору кишечника, так что принимать их следует только по назначению врача). Сульфаниламид как бы конкурирует с пара-аминобензойной кислотой за активный центр фермента, поэтому такие ингибиторы получили название конкурентных. В присутствии конкурентных ингибиторов
Существует еще один класс ингибиторов – необратимые. Они ковалентно связываются с молекулой фермента. Так, антибиотик пенициллин необратимо связывается с микробным ферментом гликопептид-транспептидазой, синтезирующим муреин (см. урок 3), и нарушает синтез клеточной стенки. Целый ряд мощных нервно-паралитических боевых отравляющих веществ (зарин, зоман, V-газы) необратимо ингибируют фермент ацетилхолин-эстеразу, необходимый для расслабления скелетных мышц. В результате отравления этими веществами дыхание становится невозможным из-за спазма дыхательных мышц, и наступает смерть – смертельная доза для человека вещества VX составляет всего 0,0004 г. В клетке активность многих ферментов регулируется. Одним из наиболее распространенных механизмов регуляции активности ферментов является аллостерическая регуляция. У ферментов, регулируемых таким способом, кроме активного центра имеется еще один очень важный участок – аллостерический центр. Он обратимо связывает специальные регуляторы, обычно это небольшие молекулы массой менее 1 килодальтона. После связывания регулятора конформация всей белковой глобулы изменяется, и фермент изменяет эффективность своей работы.
Одни аллостерические регуляторы ингибируют активность фермента, тогда как другие активируют ее. Некоторые ферменты имеют несколько аллостерических центров. Аллостерическая регуляция часто используется в обмене веществ для ингибирования конечным продуктом. Представьте себе, что в организме синтезируется некоторое вещество Z, концентрацию которого необходимо поддерживать на постоянном уровне. Это вещество синтезируется из предшественника А в несколько стадий: Другой способ регуляции – кооперативность – похожа по механизму на аллостерию. Разберем явление кооперативности на примере гемоглобина – хотя этот кислород-связывающий белок и не является ферментом, принципы остаются теми же. График зависимости насыщения гемоглобина от парциального давления кислорода имеет S-образную форму и сильно отличается от кривой Михаелиса. При низкой концентрации кислорода график насыщения гемоглобина идет очень полого. При увеличении концентрации он круто взмывает вверх: белок, связывающий кислород в соответствии с уравнением Михаелиса, не смог бы обеспечить такую крутизну. Наконец, последний участок этой кривой асимптотически приближается к полному насыщению. Такое необычное поведение объясняется просто. Гемоглобин состоит из четырех субъединиц, каждая из которых способна связывать молекулу О2. При очень низкой концентрации кислорода все субъединицы гемоглобина находятся в свободном состоянии. Если концентрацию О2 немного повысить, то сперва его связывание пойдет с большим трудом. Однако когда первая субъединица все-таки свяжет кислород, то ее конформация изменится, и это изменение передастся на соседние субъединицы. Они будут связывать кислород легче, чем первая, и кривая связывания стремительно пойдет вверх. Такое повышение сродства к субстрату у других субъединиц после связывания его первой субъединицей называется положительной кооперативностью. Механизм этого явления состоит в том, что изменение конформации одной субъединицы белка вызывает изменение пространственной структуры всей белковой молекулы.
Физиологическое значение этого свойства гемоглобина огромно. Парциальное давление кислорода в крови, выходящей из легких, составляет около Еще одним важнейшим механизмом регуляции активности белков является ковалентная модификация. Белки могут подвергаться различным химическим изменениям. Очень распростран ограниченный протеолиз белковых молекул. Многие пищеварительные ферменты синтезируются в форме длинных предшественников. Так, поджелудочная железа секретирует в просвет двенадцатиперстной кишки не активные ферменты трипсин и химотрипсин, а их предшественники – трипсиноген и химотрипсиноген. Трипсиноген длиннее трипсина на 6 аминокислотных остатков с N-конца. Фермент кишечника энтеропептидаза отщепляет этот лишний пептид и превращает неактивный трипсиноген в активный трипсин. Многие белковые гормоны также синтезируются в виде более длинных предшественников. Так, на рибосомах поджелудочной железы синтезируется предшественник гормона инсулина – проинсулин. Отщепление лишних аминокислот и образование зрелого инсулина происходит в секреторных пузырьках клеток поджелудочной железы. Ограниченный протеолиз играет важную роль в регуляции свертывания крови. Для образования кровяного сгустка необходимо, чтобы растворимый белок фибриноген превратился в нерастворимый фибрин. Этот процесс становится возможным после ограниченного протеолиза фибрина специальным ферментом – тромбином. Сам тромбин тоже образуется из неактивного предшественника – протромбина – с помощью ограниченного протеолиза. Активация свертывания крови – очень сложный процесс, включающий в себя целый каскад последовательно действующих протеаз. Запуск самой первой протеазы происходит при повреждении стенки кровеносного сосуда. Существует два механизма активации этого каскада реакций. При внутреннем механизме одна из неактивных протеаз вступает в контакт с белком соединительной ткани коллагеном (что возможно лишь при повреждении стенки сосуда), ее конформация меняется, она переходит в активную форму и запускает весь последующий каскад реакций. При внешнем механизме другая неактивная протеаза соединяется с одним из белков, освобождающимся из поврежденных клеток стенки кровеносного сосуда, и также переходит в активную форму. Другим распространенным видом ковалентной модификации является фосфорилирование белков – присоединение остатка фосфорной кислоты из молекулы АТФ к одному из аминокислотных остатков белковой глобулы. Целый ряд гормонов оказывают свое физиологическое действие через фосфорилирование соответствующих белков. Рассмотрим действие двух из них – адреналина и глюкагона. Оба гормона вызывают повышение концентрации глюкозы в крови. Эффективность их действия поразительна: одна молекула гормона вызывает выброс в кровь до 100 миллионов молекул глюкозы. Глюкоза запасается в клетках человека в виде полимера – гликогена (см. урок 3). Фермент гликогенфосфорилиза катализирует распад гликогена до глюкозо-6-фосфата, который затем превращается в глюкозу, а свободная глюкоза поступает в кровь. Самой медленной реакцией является первая, гликогенфосфорилазная, она и ограничивает скорость всего процесса. В спокойном состоянии потребность организма в глюкозе значительно меньше, чем при стрессе или интенсивной мышечной нагрузке, поэтому в норме фермент гликогенфосфорилаза малоактивен, а под действием адреналина и глюкагона резко активируется. На поверхности мембраны клеток печени, которые запасают гликоген, есть белки-рецепторы, способные связывать гормон. Каждому гормону соответствуют свои рецепторы. Связывание гормона с рецептором происходит за счет нековалентных взаимодействий (электростатических, водородных, гидрофобных). Как только адреналин свяжется с рецептором, конформация рецептора изменится, и он делается способным активировать особый мембранный фермент – аденилатциклазу. Рецептор, не связанный с гормоном, не может активировать этот фермент (на самом деле активация аденилатциклазы протекает гораздо сложнее, чем описано здесь). Фермент аденилатциклаза катализирует реакцию превращения АТФ в циклический аденозинмонофосфат (цАМФ) – важнейший внутриклеточный регулятор многих биохимических процессов. цАМФ путем диффузии идет в цитоплазму и аллостерически активирует специальный фермент протеинкиназу. Протеинкиназами называют ферменты, которые переносят остаток фосфата от АТФ на белок-мишень: Б–ОН + АТФ → Б–ОРО3Н– + АДФ, где Б – белок-мишень. В клетке имеется множество различных протеинкиназ, каждая из них специфически фосфорилирует только свои белки-субстраты и не действует на другие. Некоторые протеникиназы присоединяют фосфат к остаткам серина и треонина, другие же к остаткам тирозина. цАМФ активирует одну-единственную из них, которая так и называется: цАМФ-зависимая протеинкиназа; она фосфорилирует свои мишени по остаткам серина и треонина. Среди белков-мишеней цАМФ-зависимой протеинкиназы есть особый фермент – киназа фосфорилазы. В нефосфорилированном состоянии она неактивна, а в фосфорилированном – активна. Киназа фосфорилазы, как явствует из названия, сама фосфорилирует белок-мишень. Этой мишенью является фермент гликогенфосфорилаза. После фосфорилирования гликогенфосфорилаза переходит из малоактивной в высокоактивную форму, и расщепляет гликоген.
Большое усиление слабого гормонального сигнала достигается за счет многоступенчатости процесса, причем на каждой следующей стадии в работу каскада вовлекается все большее и большее количество белка.
Весь этот каскад активируется под действием адреналина за считанные секунды. Возвращение компонентов системы в исходное состояние после прекращения подачи адреналина происходит с помощью ферментов, отщепляющих фосфат с молекул белков – протеинфосфатаз. цАМФ же расщепляется ферментом фосфодиэстеразой. В разных клетках цАМФ-зависимая протеинкиназа фосфорилирует разные белки-мишени, и физиологический ответ получается разный. Через цАМФ действуют, кроме адреналина и глюкагона, такие гормоны гипофиза как адренокортикотропный, тиреотропный и гонадотропный; антидиуретический гормон, препятствующий выведению воды из организма; тканевой гормон простагландин Е2, способствующий развитию воспалительной реакции. Некоторые протеинкиназы фосфорилируют в белках-мишенях не серин и треонин, а тирозин. Многие из этих тирозиновых протеинкиназ являются рецепторами особых белков – факторов роста (их еще иногда называют «гормонами клеточного деления»). Одним из таких белков является соматомедин С. Гипофизарный гормон роста оказывает свое физиологическое действие опосредованно: он стимулирует выделение печенью соматомедина С. Этот белок активирует деление клеток соединительной ткани фибробластов, рост мышечной ткани, рост хрящей. Другим веществом, ускоряющим деление клеток, является фактор роста эпидермиса. Он в больших количествах содержится в слюне, так что животные зализывают раны не только из-за бактерицидного действия слюны, но и потому, что она ускоряет рост поврежденного эпителия. Рецепторы обоих названных факторов роста являются тирозиновыми протеинкиназами. После активации тирозиновых протеинкиназ включается каскад реакций, приводящий к запуску удвоения ДНК, а потом и клеточного деления. В раковых клетках нарушается регуляция этих процессов. Некоторые опухолевые клетки начинают сами выделять факторы роста, которые активируют их же собственное деление. У других злокачественно перерожденных клеток происходят мутации в генах рецепторов факторов роста, и в результате они становятся активными без всякого внешнего сигнала. В итоге клетка начинает бесконтрольно делится, и образуется раковая опухоль. Некоторые современные противоопухолевые лекарственные препараты (эрлотиниб, иматиниб) специфически угнетают ферментативную активность таких «взбесившихся рецепторов» и тормозят рост опухоли. Краткое содержание урока
|