|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Динамическая биохимия изучает химические реакции, протекающие в живом организме. Вся совокупность реакций обмена веществ называется метаболизмом. Метаболические реакции условно можно разделить на две большие группы: реакции синтеза необходимых клетке молекул (их совокупность называется пластическим обменом, или анаболизмом) и реакции расщепления и окисления, служащие для обеспечения энергетических потребностей клетки (это реакции энергетического обмена, или катаболизма). Последовательная цепь биохимических реакций называется метаболическим путем. Некоторые из метаболических реакций протекают в физиологических условиях только в одну сторону. Так, в пищеварительном тракте происходит расщепление белков до коротких пептидов и аминокислот, полисахаридов – до моносахаридов, но не наблюдается сколько-нибудь значительного синтеза полимерных молекул из этих мономеров. Другие же реакции обратимы: например, карбоангидразная реакция
катализируемая ферментом эритроцитов, протекает по-разному в легочных капиллярах и капиллярах периферических тканей. В легких углекислый газ удаляется из кровотока, и данная реакция идет слева направо. В остальных тканях углекислота, образовавшаяся в ходе обмена веществ, переходит в кровяное русло, и эта реакция идет справа налево. Для понимания закономерностей метаболизма необходимо знать, является ли данная реакция обратимой или необратимой, и как повлияет на ее протекание изменение концентраций исходных веществ и продуктов. Рассмотрим некую обратимую химическую реакцию превращения веществ A и B в вещества C и D:
Скорость прямой реакции будет пропорциональна концентрациям веществ A и B:
В этом уравнении
Отметим, что если в уравнении реакции у исходных веществ и продуктов коэффициенты не равны единице (т. е. уравнение имеет вид
Законы термодинамики, описывающие энергетику химических реакций и возможность их протекания, были сформулированы для неживых систем, однако они полностью применимы к живым клеткам и организмам. Встречающееся в околонаучных и популярных изданиях утверждение, что жизнь не подчиняется законам физики и химии, не имеет ничего общего с действительностью. Живые системы могут лишь использовать те или иные физические законы для своих нужд. Рассчитать направление протекания реакций позволяют термодинамические уравнения. На уроках химии вы узнали, что многие самопроизвольно протекающие реакции экзотермичны, т. е. сопровождаются выделением теплоты. Практически все биохимические процессы протекают при постоянном давлении, равном атмосферному, и при постоянном объеме системы. Для проведения расчетов в таких условиях удобно воспользоваться специальной величиной – энтальпией. Изменение энтальпии в ходе реакции, обозначаемое Δ Тепловой эффект реакции – не единственный фактор, влияющий на направление ее протекания. Так, процесс диффузии протекает всегда в одном направлении (см. урок 1): вещество диффундирует из участка с большей концентрацией в участок с меньшей, но выделения тепла при этом нет. Другим важным параметром является изменение энтропии системы. В первом приближении, энтропия где Из повседневного опыта мы знаем, что без подведения энергии извне самопроизвольно совершаются лишь те процессы, в ходе которых беспорядок возрастает (можно провести такую аналогию: если не убирать рабочий стол, то вскоре там воцарится полный беспорядок, а вот для наведения порядка на нем придется затратить немало энергии). Второй закон термодинамики гласит, что если в ходе реакции не происходит изменения энтальпии, то самопроизвольно могут идти лишь те реакции, в ходе которых энтропия растет (т. е. Δ
Здесь Δ Если Δ Существуют специальные таблицы термодинамических величин, где указаны Δ Рассчитаем в качестве примера, сможет ли в стандартных условиях протекать реакция:
Итак, Δ В энергообеспечении живых организмов важнейшую роль играет реакция гидролиза АТФ (подробнее о ней написано ниже): АТФ4– + Н2О = АДФ2– + НРО42– . Δ Следует заметить, что величина Δ Δ
где Δ Δ
Эта формула позволяет легко рассчитать равновесные концентрации субстратов и продуктов реакции, если известно ее Δ Величины Δ Итак, самопроизвольно могут протекать лишь те реакции, которые сопровождаются уменьшением свободной энергии Гиббса, т. е. экзергонические. Однако для клеточных нужд часто бывает необходимо провести эндергонические реакции (очень часто, хотя и не всегда, реакции синтеза являются эндергоническим, а реакции распада – экзергоническими). В этом случае клетка сопрягает необходимую ей эндергоническую реакцию с какой-нибудь сильно экзергонической реакцией, так что в итоге свободная энергия Гиббса все-таки уменьшится. Допустим, клетке необходимо синтезировать некое вещество X–Y. У реакции прямого синтеза:
и самопроизвольно она идти не может. Но в клетке имеется другое соединение A–B, которое гидролизуется с выделением большого количества энергии:
Представим теперь, что вместо одностадийного синтеза вещества X–Y в клетке идут две последовательные реакции:
Суммарно получается:
Каждая из двух последовательных реакций является экзергонической, может протекать самопроизвольно, и в результате клетка получает возможность провести синтез необходимого ей вещества. Изложенная здесь схема синтеза конечного продукта в одну стадию редко встречается в реальных метаболических путях: обычно для получения нужного соединения требуется много (иногда более десятка) промежуточных продуктов. Отметим, что ферменты, как всякие катализаторы, могут лишь ускорять прохождение реакций, но не могут сделать эндэргоническую реакцию экзэргонической или наоборот. Соединения, при гидролизе которых выделяется большое количество энергии, называются макроэргами; гидролизуемая связь носит название макроэргической связи. Энергии гидролиза некоторых макроэргов представлены в таблице 1, о биологических функциях этих соединений мы расскажем в этой и следующих главах.
Для сравнения: Δ Каждое макроэргическое соединение несет определенную химическую группу, которую оно может присоединять к другим молекулам (в реакции гидролиза эта группа «присоединяется» к воде). У нуклеотидтрифосфатов, а также креатинфосфата и пирофосфата, такой группой является остаток фосфорной кислоты; у ацетил-коэнзима А – ацетильная группа; у карбоксибиотина – карбоксильная группа; у аминоацил-тРНК – остаток аминокислоты. Несмотря на большую энергию гидролиза, макроэрги достаточно стабильны в физиологических условиях и не подвержены спонтанному расщеплению, которое привело бы к бесполезному рассеянию запасенной в них энергии в виде тепла. В клетке самым важным макроэргом, участвующем в наибольшем количестве реакций, является АТФ – аденозинтрифосфат. Молекула АТФ состоит из аденина, рибозы и трех остатков фосфорной кислоты. АТФ содержит две макроэргические связи с примерно равной энергией, однако в большинстве реакций участвует связь при конечном атоме фосфора, из АТФ при этом образуется аденозиндифосфат – АДФ.
В некоторых реакциях, требующих для своего прохождения большего количества энергии, происходит распад АТФ до АМФ и пирофосфата, который затем расщепляется ферментом пирофосфатазой до неорганического фосфата. Тем самым равновесие реакции смещается в сторону образования продуктов (в соответствии с принципом ле-Шателье, выводя один из продуктов реакции, мы смещаем ее равновесие слева направо). АМФ, образующийся при втором способе распада АТФ, регенерируется до АДФ в ходе реакции, катализируемой ферментом аденилаткиназой:
Реакция легко обратима, поскольку энергия единственной макроэргической связи АДФ примерно равна энергии любой из двух связей АТФ. При клеточном рН АТФ находится в ионизированной форме АТФ4– (и в меньших количествах АТФ3–), а АДФ – в форме АДФ3– (и в меньших количествах АДФ2–). Концентрация АТФ в клетке значительно выше, чем концентрация АДФ (обычно в несколько сотен раз), поэтому Δ АТФ используется во многих путях синтезов необходимых организму веществ (реакции с участием АТФ будут рассмотрены позднее в разделах, посвященных соответствующим метаболическим путям). Другие макроэрги также используются в синтетических метаболических путях, но в меньшем числе реакций. Роль АТФ в клетке не ограничивается только анаболическими реакциями обмена веществ. Энергия гидролиза АТФ необходима для всех видов механических работ, выполняемых эукариотической клеткой. Так, мышечное сокращение и амебоидное движение происходят за счет расщепления АТФ комплексом белков миозина и актина. Для движения эукариотических жгутиков (а также хвоста сперматозоида) необходим гидролиз АТФ белком динеином. Для передвижения органелл внутри клетки также требуется энергия расщепления АТФ. Гидролиз АТФ необходим и для активного транспорта многих ионов через клеточные мембраны. Так, фермент Na+/K+ – АТФаза, расщепляя 1 молекулу АТФ, выкачивает из клетки через наружную мембрану 3 иона Na+ и закачивает внутрь 2 иона K+. Фермент Са2+ – АТФаза переносит ион Са2+ через мембрану – наружную или эндоплазматической сети – расщепляя 1 молекулу АТФ. Весьма приблизительные подсчеты показали, что из всего количества АТФ, синтезируемого в организме крысы, около В клетках с интенсивным обменом веществ в больших количествах содержится соединение, более богатое энергией, чем АТФ. Оно называется креатинфосфат. АТФ и креатинфосфат могут обмениваться своими макроэргическими фосфатами с помощью специального фермента креатинкиназы. Реакция:
является обратимой. Креатинфосфат в больших количествах содержится в клетках поперечно-полосатых мышц, где он играет роль «энергетического буфера»: когда в клетке мало АТФ, он отдает свой фосфат молекуле АДФ, а когда в клетке много АТФ, то снова образуется креатинфосфат.
Синтез АТФ из АДФ и фосфата происходит тремя различными путями: анаэробного синтеза, окислительного фосфорилирования и фотофосфорилирования.
Было установлено, что за сутки в организме взрослого человека среднего веса вырабатывают около 40 кг АТФ, между тем как содержание этого вещества – всего около 50 г. Следовательно, в течение суток эти 50 г АТФ должны восемьсот раз расщепиться до АДФ и вновь синтезироваться. Если сравнить три пути синтеза АТФ: с помощью креатинфосфата, путем анаэробного превращения и путем окислительного фосфорилирования, то нетрудно догадаться, что первый из них – самый быстрый, поскольку включает всего одну реакцию; второй протекает помедленнее, третий – еще медленнее. Были проведены исследования энергетического обеспечения мышечного сокращения у спортсменов, выполняющих различные виды работы. Оказалось, что кратковременная, импульсная физическая нагрузка (например, поднятие штанги) производится за счет внутриклеточных запасов АТФ. Бег на дистанции 50–90 м осуществляется за счет энергии креатинфосфата. Затем в дело вступает процесс анаэробного синтеза АТФ – гликолиз, а на длинных дистанциях главную роль играет окислительное фосфорилирование. Другие нуклеотидтрифосфаты имеют гораздо более узкое применение в клеточном метаболизме. Как было указано в уроке 7, ГТФ, УТФ и ЦТФ (вместе с АТФ) используются для синтеза РНК, а их дезоксипроизводные (дАТФ, дГТФ, дЦТФ и дТТФ) – в синтезе ДНК. При этом энергия гидролиза этих соединений почти одинакова.
Краткое содержание урока
|




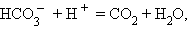
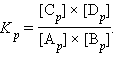 (9.1)
(9.1)
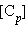 и
и 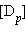 обозначают концентрации продуктов реакции C и D в состоянии равновесия,
обозначают концентрации продуктов реакции C и D в состоянии равновесия, 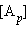 и
и 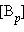 обозначают концентрации вступающих в реакцию веществ A и B в состоянии равновесия. Величина
обозначают концентрации вступающих в реакцию веществ A и B в состоянии равновесия. Величина 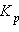 называется
называется 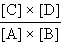

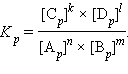 (9.2)
(9.2)
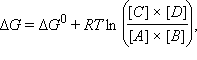 (9.5)
(9.5)