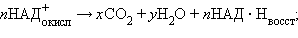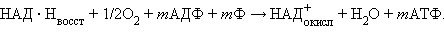|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Процессы анаэробного брожения служили главным источником энергии для всего живого в те времена, когда в атмосфере Земли еще не было кислорода. Его появление открыло принципиально новые возможности получения энергии. Кислород – хороший окислитель, а при окислении органических веществ выделяется в десятки раз больше энергии, чем в ходе брожения. Так, в ходе реакции окисления глюкозы Естественно, клетки стали использовать открывшиеся возможности. Синтез АТФ в аэробных условиях значительно эффективнее анаэробных синтезов: если при утилизации 1 молекулы глюкозы в процессах брожения образуется 2 молекулы АТФ, то в ходе окислительного фосфорилирования – около 30 (по старым данным – 38). Подробнее мы поговорим об энергетическом балансе на уроке 12. Окислительным превращениям подвергаются различные органические вещества – промежуточные метаболиты обмена аминокислот, сахаров, жирных кислот и др. Было бы нелогично создавать для каждого из них свой собственный метаболический путь. Гораздо удобнее сначала окислять все эти вещества одним, унифицированным окислителем, а затем уже окислять образовавшуюся восстановленную форму такого «универсального окислителя» кислородом. В качестве этого универсального окислительно-восстановительного промежуточного соединения в клетке используется никотинамидадениндинуклеотид – НАД; мы уже говорили об этом соединении на уроке 10. Как указывалось в 10-м уроке, это вещество может существовать в двух формах: окисленной НАД+ и восстановленной НАД∙Н. Для превращения первой формы во вторую необходимо поступление двух электронов и одного иона Н+. Система
Итак, в самом общем виде совокупность реакций распада различных веществ в аэробных условиях (то есть в присутствии кислорода) можно представить так:
Реакции первого этапа идут или в цитоплазме, или в митохондриях, тогда как реакции второго этапа – только в митохондриях. На этом уроке мы рассмотрим лишь реакции первой группы, реакции второй группы будут изучаться на 12-м уроке. В клетке имеется еще один кофермент – ФАД (флавинадениндинуклеотид) – который тоже служит окислительно-восстановительным челноком, но используется в меньшем числе реакций, чем НАД; он синтезируется из витамина В2 – рибофлавина.
Давайте рассмотрим конкретные метаболические пути – окислительные превращения глюкозы и жирных кислот. Аэробный гликолиз начинается с тех же реакций, что и уже рассмотренный нами анаэробный гликолиз ( Когда гликолиз протекает в аэробных условиях, пировиноградная кислота не будет восстанавливаться, а будет транспортироваться в митохондрию и окисляться. Сначала она превратится в остаток уксусной кислоты, ацетил, ковалентно присоединенный к особому коферменту – так называемому коэнзиму А.
Эту необратимую реакцию проводит митохондриальный фермент пируватдегидрогеназа, который окисляет пировиноградную кислоту до ацетил-коэнзима А с освобождением углекислоты. Этот фермент содержит несколько коферментов, необходимых для его работы: тиаминпирофосфат (образуется из витамина В1 – тиамина), липоевую кислоту (она иногда применяется в качестве укрепляющей здоровье пищевой добавки) и ФАД (про него мы уже писали выше). Это очень сложный белок, состоящий из многих субъединиц, его молекулярная масса составляет несколько миллионов дальтон. Коэнзим А, к которому присоединяется ацетильный остаток, синтезируется из пантотеновой кислоты, также являющейся витамином (витамин В5). Ацетил-коэнзим А является макроэргом, столь же богатым энергией, сколь и АТФ (
Пируватдегидрогеназа играет важную роль в регуляции аэробного катаболизма глюкозы. Этот фермент ингибируется НАД∙Н и ацетил-КоА – своими конечными продуктами - по принципу отрицательной обратной связи. Регуляция осуществляется с помощью сложного механизма, включающего и аллостерию, и ковалентную модификацию этого белка. Данный фермент также ингибируется жирными кислотами. Жирные кислоты – более калорийный источник энергии, и кроме того, они менее ценны для проведения синтетических процессов в клетке, поэтому при наличии и глюкозы (ведь пируват образуется из нее), и жирных кислот целесообразно сперва окислять жирные кислоты. Затем ацетил-коэнзим А будет окисляться до CО2 и Н2О в ходе процесса, называемого циклом Кребса (в честь Г. Кребса, впервые описавшего его в 1937 г.).
Основная роль цикла Кребса в энергетическом обмене клетки состоит в получении восстановленных коферментов НАД∙Н и ФАД∙Н2, которые затем будут окисляться кислородом для синтеза АТФ из АДФ и фосфата (этот процесс мы рассмотрим на уроке 12). Восстановление коферментов достигается за счет полного окисления остатка уксусной кислоты до CО2 и Н2О. Цикл начинается с переноса остатка уксусной кислоты из ацетил-КоА к щавелевоуксусной кислоте (в нейтральной среде это ион оксалоацетата), в результате чего образуется лимонная кислота (точнее, цитрат-ион), а коэнзим А освобождается. Эта реакция катализируется ферментом цитратсинтазой, она необратима.
Лимонная кислота затем в две стадии переходит в изолимонную (ее анион называется изоцитрат), обе стадии ускоряет один фермент – аконитаза.
Участвующие на этом этапе органические кислоты имеют три карбоксильные группы, иногда и весь цикл называют «циклом трикарбоновых кислот», но это название неудачное – уже на следующей стадии одна карбоксильная группа теряется. Поэтому часто цикл называют «циклом трикарбоновых и дикарбоновых кислот».
Эту важнейшую реакцию катализирует фермент изоцитратдегидрогеназа. Изолимонная кислота при этом окисляется до α-кетоглютаровой кислоты, теряя СО2, а НАД+ восстанавливается до НАД∙Н (именно он является окислителем в этой реакции). В физиологических условиях реакцию можно считать необратимой. α-кетоглютаровая кислота уже на следующей стадии подвергается дальнейшему окислению. Химически это кислота похожа на пировиноградную – обе являются α-кетокислотами – и окисление их протекает похоже.
В обоих случаях выделяется углекислота, окислитель НАД+ восстанавливается до НАД∙Н, а укороченный остаток кислоты в ходе реакции присоединяется к коэнзиму А. Только пировиноградная кислота давала двухуглеродный остаток (ацетил-КоА), а вот α-кетоглютаровая дает четырехуглеродный – сукцинил-коэнзим А. α-кетоглютаратдегидрогеназная реакция так же необратима, как и пируватдегидрогеназная, а катализирующий ее фермент содержит те же коферменты. Продукт реакции сукцинил-коэнзим А, столь же богат энергией, как и ацетил-коэнзим А. Было бы глупо рассеивать эту энергию в тепло, и клетка не допускает такого расточительства. Сукцинил-КоА не просто гидролизуется до янтарной кислоты (точнее, сукцинат-иона) и коэнзима А, в ходе этой реакции происходит синтез ГТФ из ГДФ и фосфата, а ГТФ так же макроэргичен, как АТФ.
Янтарная кислота подвергается дальнейшему окислению. Однако ее окислителем служит не привычный нам НАД+, а другой кофермент – ФАД. Природа использовала именно этот кофермент вовсе не для того, чтобы отравить жизнь студентам и школьникам, изучающим цикл Кребса. Дело в том, что в янтарной кислоте окислению подвергается весьма инертная группа –СН2–СН2–. Вспомните курс органической химии – алканы в общем-то малореакционноспособны по сравнению со спиртами и альдегидами, окислить их гораздо труднее. Вот и здесь клетка вынуждена использовать более сильный флавиновый окислитель, а не обычный никотинамидный. Янтарная кислота при этом превращается в фумаровую, реакцию ускоряет фермент сукцинатдегидрогеназа.
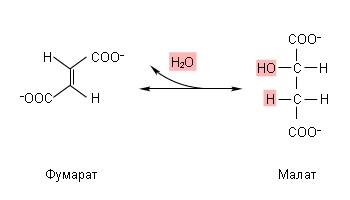
Фумаровая кислота, присоединяя воду, превращается в яблочную (точнее, в малат-ион).
Последней реакцией цикла является окисление яблочной кислоты до щавелевоуксусной, окислителем служит хорошо знакомый нам НАД+, катализирует реакцию фермент малатдегидрогеназа.
Цикл замкнулся. В итоге за 1 оборот цикла происходит окисление 1 остатка уксусной кислоты следующим образом:
Образовавшиеся НАД∙Н и ФАД∙Н2 затем окисляются в митохондриях, обеспечивая энергией синтез АТФ. В цикле Кребса образуется также 1 молекула ГТФ, богатого энергией соединения, способного передать фосфатный остаток на АДФ и образовать АТФ. Молекула щавелевоуксусной кислоты выходит из цикла без всяких изменений – она служит как бы катализатором окисления ацетил-коэнзима А, а сама возвращается в исходное состояние в конце каждого оборота цикла. Ферменты цикла Кребса расположены в матриксе митохондрий (кроме сукцинатдегидрогеназы, она находится на внутренней митохондриальной мембране). В цикле Кребса подвергаются регуляции сразу несколько ферментов. Изоцитратдегидрогеназа ингибируется НАД∙Н – конечным продуктом цикла, и активируется АДФ – веществом, образующимся при энергетических затратах. Важную роль в регуляции цикла играет также обратимость малатдегидрогеназной реакции. При высоких концентрациях НАД∙Н эта реакция протекает справа налево, в сторону образования малата. В результате концентрация оксалоацетата падает, и скорость цитратсинтазной реакции снижается. Образовавшийся малат может использоваться в других метаболических процессах. Цитратсинтаза еще и аллостерически ингибируется АТФ. Регулируется и активность α-кетоглютаратдегидрогеназы. Цикл Кребса участвует в окислительных превращениях не только глюкозы, но также жирных кислот и аминокислот. После проникновения через наружную мембрану жирные кислоты сперва активируются в цитоплазме путем присоединения коэнзима А, при этом затрачиваются две макроэргические связи АТФ:
Пирофосфат тут же расщепляется ферментом пирофосфатазой, смещая равновесие реакции вправо. Ацил-коэнзим А затем переносится в митохондрию. В этих органеллах действует ферментативная система так называемого β-окисления жирных кислот. Процесс β-окисления протекает поэтапно. На каждом этапе от жирной кислоты отщепляется двухуглеродный фрагмент в виде ацетил-коэнзима А, а также происходит восстановление НАД+ до НАД∙Н и ФАД до ФАД∙Н2.
В ходе первой реакции происходит окисление группы –СН2-СН2–, расположенной около карбонильного атома углерода. Как и при окислении сукцината в цикле Кребса, окислителем служит ФАД. Затем (вторая реакция) происходит гидратация двойной связи образовавшегося непредельного соединения, при этом третий атом углерода становится гидроксилированным – образуется β-оксикислота, присоединенная к коэнзиму А. В ходе третьей реакции происходит окисление этой спиртовой группы до кетогруппы, в качестве окислителя используется НАД+. Наконец, с образовавшимся β-кетоацил-коэнзимом А реагирует другая молекула коэнзима А. В результате отщепляется ацетил-коэнзим А, и ацил-КоА укорачивается на два углеродных атома. Теперь циклический процесс будет протекать по второму заходу, остаток жирной кислоты укоротится еще на один ацетил-КоА, и так до полного расщепления жирной кислоты. Из четырех реакций β-окисления только первая является необратимой, остальные – обратимы, их прохождение слева направо обеспечивается постоянным выводом конечных продуктов. Суммарно β-окисление пальмитоил-коэнзима А протекает согласно уравнению:
Ацетил-КоА затем поступает в цикл Кребса. НАД∙Н и ФАД∙Н2 окисляются в митохондриях, обеспечивая энергией синтез АТФ. Катаболизм аминокислот протекает также через цикл Кребса. Различные аминокислоты поступает в цикл различными метаболическими путями, их рассмотрение слишком сложно для данного курса. Цикл Кребса используется клеткой не только для энергетических нужд, но и для синтеза целого ряда необходимых ей веществ. Он является центральным метаболическим путем и в катаболических, и в анаболических процессах клетки. Сам Ганс Кребс сперва теоретически предположил, что превращения ди- и трикарбоновых кислот протекают циклически, а затем проделал серию опытов, в которых показал взаимопревращения этих кислот и их способность стимулировать аэробный гликолиз. Однако решительные доказательства протекания этого метаболического пути именно так, а не иначе, были получены с помощью экспериментов с изотопной меткой. Представьте себе, что вы в определенном промежуточном метаболите цикла Кребса заменили обычный природный изотоп на радиоактивный. Теперь это вещество как бы несет на себе радиоактивную метку, и это позволяет отследить его дальнейшую судьбу. Такое меченое соединение можно добавить к клеточному экстракту и через некоторое время посмотреть, во что оно превратится. Для этого можно отделить небольшие молекулы от макромолекул (например, осаждением последних) и разделить их смесь хроматографическим методом ( Определять радиоактивность можно различными путями. Самый простой способ – по засвечиванию фотографической эмульсии, ведь сама радиоактивность была открыта А. Беккерелем именно благодаря способности радиоактивного излучения засвечивать фотопластинку. Например, если мы разделили смесь веществ тонкослойной хроматографией и знаем, где расположено пятно того или иного вещества, то можно просто приложить к нашей хроматограмме фотопластинку. Тогда участок фотопластинки, соприкасавшийся с пятном, содержащим радиоактивность, окажется засвеченным. Остается только посмотреть, около пятен каких веществ фотоэмульсия засветилась, и сразу же можно сказать, что именно в эти вещества перешла радиоактивная метка. Этот метод называется радиоавтографией. С его помощью можно изучать не только малые молекулы, но и крупные – например, добавив к живой клетке радиоактивно меченый уридин. Как мы уже говорили на 7-м уроке, уридиновые нуклеотиды входят в состав РНК, так что вскоре эта макромолекула будет радиоактивно помечена. Теперь можно отслеживать местонахождение и транспортировку РНК в клетке. Для этого нужно зафиксировать клетки, чтобы макромолекулы выпали в осадок и не уплыли при дальнейших процедурах, залить их фотоэмульсией и через некоторое время посмотреть в микроскоп, где появились засвеченные участки. Радиоавтография позволяет непосредственно наблюдать за судьбой молекул в клетке. Однако у метода есть и недостаток – он дает лишь качественную характеристику наличия радиоактивной метки и не позволяет измерить ее количественно. Для точных количественных измерений используется другой способ. β-частицы, вылетающие из радиоактивных изотопов, вызывают свечение особых веществ – сцинтилляторов. Интенсивность этого свечения можно точно измерить с помощью специального прибора – сцинтилляционного счетчика. Точно измерив свечение, мы можем точно определить и количество радиоактивного изотопа. Однако использование сцинтилляционного счетчика позволяет измерить лишь общее количество радиоактивного изотопа в пробе. Если мы зальем раствором сцинтиллятора клеточную суспензию, то сможем определить суммарное количество радиоактивного соединения, но не его распределение по органеллам. Для этого нам придется выделять отдельные клеточные органеллы и измерять радиоактивность в них. Обычно в биохимических исследованиях применяют такие изотопы как тритий 3Н, углерод 14С, фосфор 32Р и серу 35S. Краткое содержание урока
|




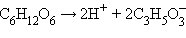 только 47 ккал на моль.
только 47 ккал на моль. 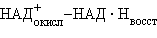 играет роль окислительно-восстановительного челнока, переносящего электроны от различных органических веществ к кислороду: на первой стадии НАД+ отнимает электроны у органических веществ, окисляя их в конце концов до CО2 и Н2О (разумеется, не в одну стадию, а через многочисленные промежуточные соединения); на второй стадии кислород окисляет НАД∙Н, образовавшийся в ходе первой стадии, и возвращает его вновь в окисленное состояние.
играет роль окислительно-восстановительного челнока, переносящего электроны от различных органических веществ к кислороду: на первой стадии НАД+ отнимает электроны у органических веществ, окисляя их в конце концов до CО2 и Н2О (разумеется, не в одну стадию, а через многочисленные промежуточные соединения); на второй стадии кислород окисляет НАД∙Н, образовавшийся в ходе первой стадии, и возвращает его вновь в окисленное состояние.