

 |
 |
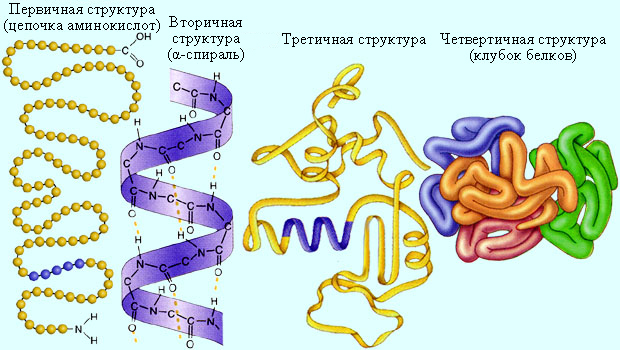
Белки – высокомолекулярные соединения, образующиеся в результате связывания отдельных полипептидных цепей водородными связями. Все белки подразделяются на глобулярные и фибриллярные. Глобулярные белки компактны, обладают сферической и приближенными к ней формами. Глобулярный белок диаметром 2,5 нм представляет собой полипептидную цепь длиной до 50 нм, свернутую в клубок. Фибриллярные белки обычно вытянуты и входят в состав тканей, мышц, волос. Полипептидные цепи такого белка, свернутые в винтовую спираль, ориентированы параллельно друг другу. На рис. 13.3 приведена структура нити мышечного белка. Одной из важнейших вторичных структур является α-спираль, впервые найденная Л. Полингом и Р. Б. Кори.
 |
| Рисунок 13.3 Структура нити мышечного белка
|
Белковую природу имеют многочисленные ферменты, которые катализируют реакции определенного типа. Ферментам свойственна высокая избирательность, наибольшая активность при нормальной температуре организма, зависимость ферментной активности от pH. Ферменты разделяются на шесть классов:
Оксидоредуктазы – катализируют окислительно-восстановительные процессы.
Трансферазы – катализируют перенос химических групп (радикалов).
Гидролазы – катализируют гидролитические процессы.
Лиазы – обеспечивают присоединение по двойным связям или их образование.
Изомериазы – участвуют в процессах изомеризации.
Синтетазы – обеспечивают реакции конденсации двух молекул с участием фосфатных групп.
Для обеспечения каталитической функции многие ферменты содержат в молекуле небелковую часть – кофактор. Кофакторами могут быть органические вещества или ионы биометаллов, а также 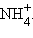
 |
 |
 |

