Глава 3. Химическая связь
3.3.7. Метод Гиллеспи–Найхолма
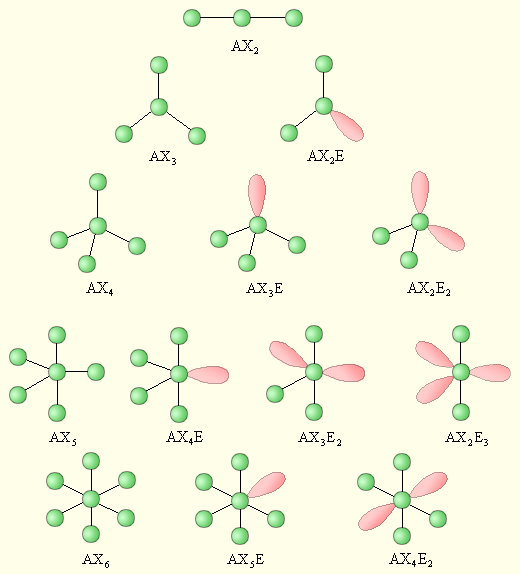
Этот метод основан на том, что реальная геометрия молекулы определяется не только гибридизацией АО, но и числом двухэлектронных двухцентровых связей (связывающих электронных пар) и наличием неподеленных электронных пар (Е). Тогда при одинаковой гибридизации молекула метана соответствует формуле CH4, аммиака – NH3E, воды – H2OE2. При этом каждая молекула представляет собой геометрическую фигуру, вписанную в сферу. Молекула будет иметь минимум энергии, если все связывающие электронные пары будут равноудалены друг от друга на поверхности сферы. Неподеленная электронная пара занимает на сфере большую площадь, что приводит к уменьшению валентного угла тем больше, чем больше в молекуле неподеленных электронных пар E. Рассмотрим структуры молекул от трехатомных до семиатомных (рис. 3.18).
Для трехатомной молекулы AX2 возможно единственное строение – линейное, четырехатомная молекула AX3 будет плоской в форме равностороннего треугольника, пятиатомная AX4 – тетраэдрической, шестиатомная AX5 – иметь форму треугольной бипирамиды, а семиатомная AX6 – форму октаэдра.
Иное дело – наличие в молекуле неподеленных электронных пар. В этом случае геометрия молекулы существенно меняется. Молекула AX2E будет уже не линейной, а угловой, AX3E будет иметь форму треугольной пирамиды, а AX2E2 вновь будет угловой, причем угол будет существенно меньше тетраэдрического (например, H2O). В молекуле AX4E возможная структура – треугольнопирамидальная. Молекула AX5E имеет структуру квадратной пирамиды, а молекула AX4E2 – квадрата.
 1 1
|
| Рисунок 3.18
|











