

 |
 |
Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.
К безразмерным концентрациям (долям) относятся следующие концентрации:
Массовая доля растворенного вещества
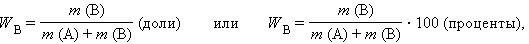 |
Объемная доля растворенного вещества σ (B) выражается в долях единицы или объемных процентах:
 |
*) Иногда объемная концентрация выражается в тысячных долях (промилле, ‰) или в миллионных долях (млн–1), ppm.
Мольная доля растворенного вещества χ (B) выражается соотношением
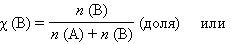 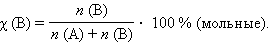 |
Сумма мольных долей 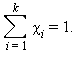
К размерным концентрациям относятся следующие концентрации:
Моляльность растворенного вещества
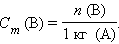 |
Молярная концентрация вещества B в растворе
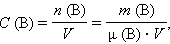 |
Молярная концентрация эквивалентов вещества B
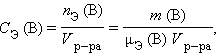 |
Титр раствора вещества B (
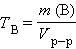 г∙мл–1 или г∙мл–1 или
|
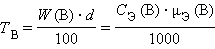 г∙мл–1. г∙мл–1.
|
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Все вещества в той или иной степени способны растворяться и характеризуются растворимостью. Некоторые вещества неограниченно растворимы друг в друге (вода–ацетон, бензол–толуол, жидкие натрий–калий). Большинство соединений ограниченно растворимы (вода–бензол, вода–бутиловый спирт, вода–поваренная соль), а многие малорастворимы или практически нерастворимы (вода–BaSO4, вода–бензин).

 |
|
Модель 6.2.
Растворимость солей
|
Растворимостью вещества при данных условиях называют его концентрацию в насыщенном растворе. В таком растворе достигается равновесие между растворяемым веществом и раствором. В отсутствие равновесия раствор остается стабильным, если концентрация растворенного вещества меньше его растворимости (ненасыщенный раствор), или нестабильным, если в растворе содержится вещества больше его растворимости (пересыщенный раствор).
 |
 |
 |

