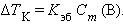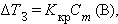Глава 6. Растворы
6.3.2. Законы Рауля
Если упругость пара растворенного вещества очень мала PB << PA, то его парциальным давлением можно пренебречь (нелетучий компонент), и тогда упругость пара над раствором будет зависеть только от парциального давления растворителя:
Это первый закон Рауля – парциальное давление над раствором прямо пропорционально мольной доле растворенного вещества. После подстановки χA = 1 – χB и несложных преобразований
получаем
Относительное понижение упругости пара над раствором равно мольной доле растворенного вещества. Это закон Рауля для нелетучего растворенного компонента. Из этого закона можно вывести два следствия, которые в объединенном виде формируются как второй закон Рауля.
 1 1
|
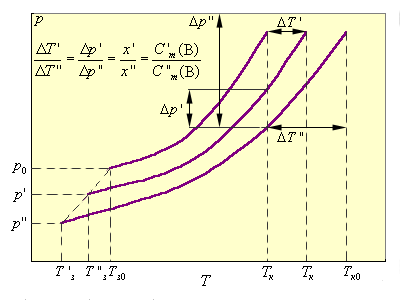
| Рисунок 6.2 Зависимость повышения температуры кипения ΔTкип и понижения температуры замерзания ΔTзам раствора от концентрации растворенного вещества.
|
На рис. 6.2 приведены зависимости P(T) чистого растворителя и двух его растворов P'(T) и P''(T).
Выразим мольную долю 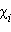 через моляльную концентрацию
через моляльную концентрацию
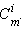 Для двухкомпонентного раствора
Для двухкомпонентного раствора 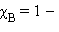
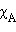 . При
. При 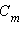 << 1 получим
<< 1 получим
Из подобия треугольников следует
По определению, при 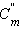 (B) = 1 моль∙
(B) = 1 моль∙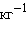 повышение температуры
повышение температуры 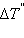 равно
равно 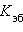 – эбулиоскопической константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:
– эбулиоскопической константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:
Проведя аналогичное исследование, касающееся понижения температуры замерзания раствора, получим
где Kкр – криоскопическая константа.
Второй закон Рауля – понижение температуры кипения и повышение температуры замерзания раствора прямо пропорционально моляльной концентрации раствора:
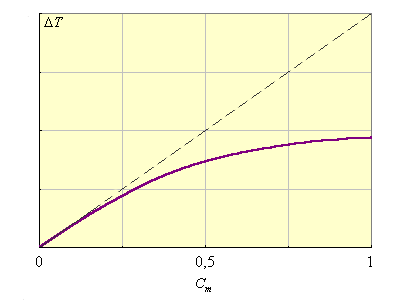
Kэб и Kкр являются экстраполяционными величинами от малых концентраций растворенного вещества, где выполняется этот закон, на Cm (B) = 1, где этот закон уже не действует (рис. 6.3). В табл. 6.2 приведены Kкр и Kэф для воды и бензола.
 2 2
|
| Рисунок 6.3 Иллюстрация справедливости второго закона Рауля для разбавленных растворов и экстраполяционной природы Kкр и Kэб |
|
|
Kкр |
Kэб |
| Вода |
1,86 |
0,52 |
| Бензол |
5,07 |
2,60 |
|
| Таблица 6.2 Криоскопические и эбулиоскопические константы для воды и бензола (град∙моль–1∙кг)
|
Второй закон Рауля дает легко осуществимую экспериментально возможность определения молекулярных масс некоторых молекулярных соединений, неспособных к диссоциации в данном растворителе. Действительно, моляльная концентрация растворенного вещества может быть представлена в виде соотношения Cm = gB ∙ 1000 / μB ∙gA, где gA – вес растворителя, gB – вес растворенного вещества, μB – его молярная масса. Тогда из ΔT = Kкр · m
получим молярную массу растворенного вещества:






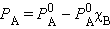

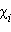 через моляльную концентрацию
через моляльную концентрацию
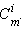 Для двухкомпонентного раствора
Для двухкомпонентного раствора 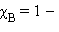
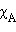 . При
. При 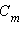
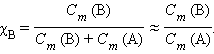
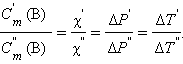
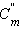 (B) = 1 моль∙
(B) = 1 моль∙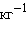 повышение температуры
повышение температуры 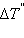 равно
равно 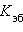 – эбулиоскопической константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации:
– эбулиоскопической константе для данного растворителя. Тогда повышение температуры кипения для данного раствора будет пропорционально его моляльной концентрации: