

 |
 |
Диаграмма плавкости веществ с неограниченной растворимостью в жидком и полной нерастворимостью в твердом состоянии
Этот тип диаграмм характерен для веществ, заметно отличающихся структурой кристаллов.
Диаграмма температура–состав строится на основании кривых охлаждения (нагревания). Кривые охлаждения – графическое изображение зависимости температуры от времени для исходных чистых веществ A и B и их смесей различного состава. Вид этих кривых свидетельствует о наличии или отсутствии фазовых превращений при некоторых определенных температурах или в интервале температур (рис. 6.11.).
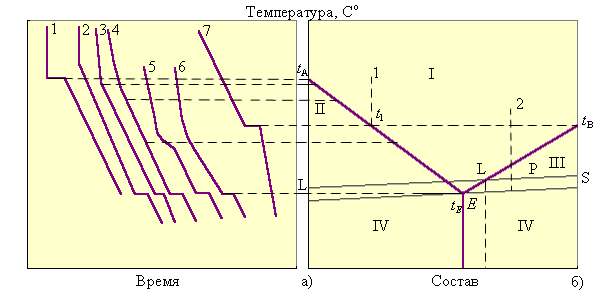 |
| Рисунок 6.11 Построение диаграммы плавкости для веществ, полностью растворяющихся в жидком и нерастворяющихся в твердом состояниях: а) кривые охлаждения; б) диаграмма плавкости
|
Расплав чистого компонента можно рассматривать как растворитель. Согласно закону Рауля, добавление второго компонента (растворенного вещества) вызывает понижение температуры кристаллизации системы (раствора). При охлаждении расплава, пока в охлаждаемой системе не происходит фазовых превращений, температура расплава падает с определенной скоростью. Появление кристаллов сопровождается выделением теплоты кристаллизации и замедляет или приостанавливает падение температуры, вызывая излом или площадку на кривой охлаждения.
Из анализа кривых охлаждения (рис. 6.11а) следует, что смеси веществ при охлаждении претерпевают по два фазовых превращения, и изломы на их кривых характеризуют начало выделения из расплава кристаллов вещества A (кривая 2) или вещества B (кривая 4), а площадки – выделение эвтектической смеси, насыщенной в отношении обоих компонентов.
Таким образом, кристаллизация жидкой смеси в отличие от кристаллизации чистого вещества (кривые 1,5) сопровождается изменением состава жидкой фазы и лежит в некотором температурном интервале. Смесь эвтектического состава (кривая 3) кристаллизуется подобно чистым компонентам при постоянной температуре, поэтому дает монотонную кривую охлаждения с горизонтальным участком при эвтектической, наименьшей для данной системы температуре.
После окончания кристаллизации идет охлаждение отвердевшей системы до температуры окружающей среды.
Определив с помощью кривых охлаждения температуры кристаллизации для смесей различных составов, строят диаграмму состояния. Способ построения ясен из рисунка 6.11б.
На рис. 6.11б:
I – гомофазная жидкая область
II, III – гетерофазные области (расплав + твердая фаза)
IV – гетерофазная область (Aтв + Bтв)
E – эвтектика (состав с наименьшей
Точка на диаграмме состояния, отвечающая составу образца, называется фигуративной.
Рассмотрим ход кристаллизации расплава с позиции правила фаз. Пока фигуративная точка 2 находится в гомогенной области I, никакие фазовые превращения не происходят, в системе имеет место дивариантное равновесие (С = 2 + 1 – 1 = 2), можно менять и температуру, и соотношение компонентов без изменения числа фаз. При температуре
Каждая система имеет строго определенный состав фаз при данной температуре. В двухфазных областях II и III, называемых областями кристаллизации, состав твердой фазы однозначен, а состав жидкой фазы может быть определен пересечением соответствующей изотермы с линией ликвидуса и отнесением на ось состава. Например, для системы Р (рис. 6.9б) состав жидкой фазы отмечен точкой PL и составляет 30% вещества А и 70% вещества В, твердая фаза – 100% В.
Отрезки канноды LS, проведенной через фигуративную точку Р, отображают относительные массовые количества жидкой и твердой фаз:
|
LP : PS = |
Так, из 100 г смеси для точки Р масса твердой фазы – около 33 г, а в жидкой – около 67 г.
Двухкомпонентная система, состоящая из воды и растворяющейся в ней соли, характеризуется диаграммой состояния эвтектического типа. Выделяющуюся в точке Е эвтектическую водно-солевую смесь называют криогидратом. Затвердевшие криогидраты состоят из мелкодисперсной смеси кристаллов льда и соли.
Криогидратные температуры некоторых солей:
|
||||||||||||||||||||
| Таблица 6.4 |
Такие составы широко используются в практике для получения низкотемпературных смесей.
Диаграмма плавкости веществ с неограниченной растворимостью в жидком и твердом состоянии
Весьма часто твердая фаза, выделяющаяся при охлаждении расплавов, состоит из кристаллов, образуемых обоими компонентами. Такая однородная система имеет переменный состав и называется твердым раствором. Твердые растворы – системы однофазные, подобно обычным жидким растворам, но в отличие от последних имеют кристаллическую структуру.
Неограниченной взаимной растворимостью в твердом состоянии обладают вещества, имеющие близкие значения атомных или ионных радиусов, энергии химической связи, сходное строение электронных оболочек и одинаковый тип кристаллической решетки (изоморфные вещества). Примерами таких систем могут служить Au–Ag, Cu–Au, Se–Ge, NaCl–NaBr и другие.
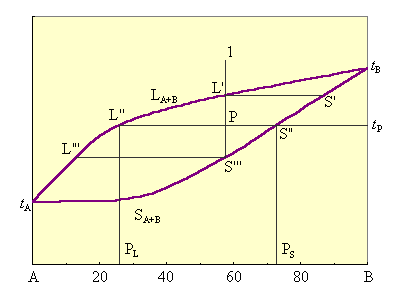 |
| Рисунок 6.12 Диаграмма плавкости для веществ, неограниченно растворимых в твердом и жидком состояниях
|
Представленная на рис. 6.12. диаграмма состоит из двух непрерывных сопряженных кривых: верхней
Точки
Рассмотрим особенности кристаллизации систем этого типа (рис. 6.12). Расплав состава, отвечающий фигуративной точке 1, охлаждаем до точки L'. Начинают выпадать кристаллы S'. При охлаждении до точки P выпадают кристаллы S'', состав расплава отвечает точке L''. По мере охлаждения состав кристаллов изменяется по кривой S' – S'' – S''', состав расплава – по кривой L' – L'' – L'''. Если отделить выкристаллизовавшиеся первые порции, обогащенные тугоплавким компонентом B, то неоднократным повторением процесса можно разделить A и B.
Составы жидкой и твердой фаз, сосуществующих при данной температуре, определяют точками пересечения изотермы соответственно с линиями ликвидуса и солидуса и отнесением их на ось составов. Так, для системы P (рис 6.12) при температуре
Аналогичный вид имеет диаграмма состав–температура для двух жидкостей, неограниченно смешивающихся в жидком и парообразном состоянии.
 |
 |
 |

