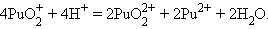Глава 8. Химические свойства элементов
8.4.2. Актиноиды
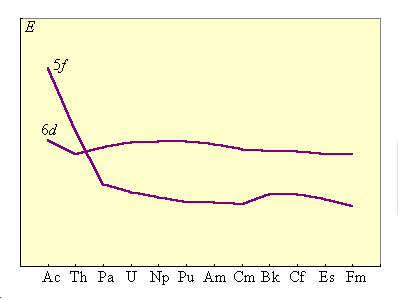
Актиноиды (Th–Lr) во многих отношениях сходны с лантаноидами: порядок заполнения 5f-уровней точно такой же, как и 4f-уровней (табл. 8.13). Хотя тяжелые актиноиды изучены мало, имеющиеся данные говорят о том, что в их ряду также наблюдается явление f-сжатия (рис. 8.16).
| Элемент |
Электронная конфигурация |
Степень окисления |
Элемент |
Электронная конфигурация |
Степень окисления |
| Торий |
Th |
5f27s2 |
3, 4 |
Берклий |
Bk |
5f97s2 |
3, 4 |
| Протактиний |
Pa |
5f37s2 |
3, 4, 5 |
Калифорний |
Cf |
5f107s2 |
2, 3 |
| Уран |
U |
5f36d17s2 |
3, 4, 5, 6 |
Эйнштейний |
Es |
5f117s2 |
2, 3 |
| Нептуний |
Np |
5f57s2 |
3, 4, 5, 6 |
Фермий |
Fm |
5f127s2 |
2, 3 |
| Плутоний |
Pu |
5f67s2 |
3, 4, 5, 6, 7 |
Менделевий |
Md |
5f137s2 |
2, 3 |
| Америций |
Am |
5f77s2 |
2, 3, 4 |
Нобелий |
Nb |
5f147s2 |
2, 3 |
| Кюрий |
Cm |
5f75d17s2 |
3, 4 |
Лоуренсий |
Lr |
5f146d17s2 |
3 |
|
| Таблица 8.13 Электронные конфигурации и степени окисления 5f-элементов (актиноидов)
|
Отличия актиноидов и лантаноидов обусловлены тем, что у актиноидов энергетические уровни 5f и 6d стабилизируются по мере возрастания атомного ядра несколько иным способом, чем у лантаноидов: у легких актиноидов более устойчивы 6d-орбитали, а у тяжелых – 5f (рис. 8.16).
Для элементов с атомными номерами 90–95 энергия 5f- и 6d-подуровней примерно одинакова. Последнее затрудняет однозначное определение электронной конфигурации элемента. Так для Np одинаково вероятны и 5f46d17s2, и 5f56d07s2 электронные состояния.
Этим объясняются различия в химии актиноидов и лантаноидов. У элементов с атомными номерами 91–95 (Th–Am) электронные переходы происходят легко. Эти элементы поливалентны и в этом подобны d-элементам. Более того, для них степень окисления III вообще мало характерна. Получен семивалентный нептуний, уран легко может быть переведен в шестивалентное состояние, протактиний проявляет степень окисления пять, а для тория трудно получить соединения, в которых он имел бы степень окисления ниже четырех.
Однако по мере заполнения 5f-уровней электронные конфигурации атомов стабилизируются, переход 5f-электронов в 6d-состояние становится все более затрудненным. Поэтому элементы Bk–Lr, ведут себя как типичные f-элементы, а по свойствам близки к лантаноидам. Для них основной степенью окисления является III.
 1 1
|
| Рисунок 8.16 Устойчивость энергетических уровней 5f и 6d у актиноидов.
|
Поскольку наиболее долгоживущими элементами являются первые 5f-элементы (Th–Am), их химические свойства изучены лучше, а многообразие проявляемых степеней окисления в значительной мере отличает их от типичных 4f-элементов и тяжелых 5f-элементов.
С водородом актиноиды образуют гидриды переменного состава (ThH2, Th4H15; PaH2–2,7; AmH2–2,7), но для урана можно получить и стехиометрический гидрид UH3. В общем случае гидриды этих элементов термически менее устойчивы, чем гидриды 4f-элементов. С кислородом актиноиды образуют оксиды, соответствующие их наиболее устойчивым степеням окисления (ThO2, PaO2, Pa2O5, NpO2 и др.). К исключительно сложным следует отнести систему уран–кислород. Характерными для урана являются оксиды UO2 – UO2,25; U3O8 и UO3, из них наиболее устойчив U3O8 (UO2∙2UO3) – урановая смолка.
Отличительной особенностью кислородсодержащих соединений актиноидов в высших степенях окисления V, VI является наличие катионных группировок 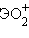 и
и 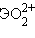 или
или 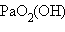 ,
, 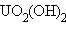 . Эти группировки называются иловыми оксоионами. Например,
. Эти группировки называются иловыми оксоионами. Например, 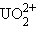 – уранил,
– уранил, 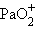 – протактинил. Оксоионы устойчивы и сохраняются без изменения в разнообразных химических реакциях:
– протактинил. Оксоионы устойчивы и сохраняются без изменения в разнообразных химических реакциях:
Особая устойчивость оксоионов объясняется тем, что связь между атомами актиноида и кислорода формально можно рассматривать как тройную:
Для ионов 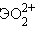 прочность связи увеличивается в ряду Am < Pu < Np.
прочность связи увеличивается в ряду Am < Pu < Np.
С галогенами актиноиды образуют многообразные галогениды ЭГn, где n = 3, 4, 5, 6. Фториды элементов в высших степенях окисления летучи, что позволило разделить изотопы урана 235U и 238U. Взаимодействие актиноидов с B, Si, C, N, P, S и Se приводит к образованию соединений нестехиометрического состава вследствие возможного присутствия элемента в разных степенях окисления.
Уменьшение радиусов элементов в ряду Th–Lr приводит к ослаблению основных свойств соединений.
Соединения актиноидов склонны к диспропорционированию. Например:
Свойства тяжелых 5f-элементов (Bk, Cf, Es, Md, No, Fm, Lr) изучены мало, поскольку они получены в виде короткоживущих радиоактивных изотопов в очень малых количествах. Однако есть основания полагать, что они подобны лантаноидам.
Актиноиды и их соединения используются в атомной энергетике. Торий используется как легирующая добавка в жаропрочных сталях, катализаторах при синтезе многих соединений, вакуумной электронике. Соли урана применяются как красители для стекла и глазурей, аналитические и фотографические препараты.







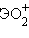 и
и 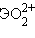 или
или 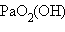 ,
, 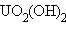 . Эти группировки называются иловыми оксоионами. Например,
. Эти группировки называются иловыми оксоионами. Например, 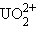 – уранил,
– уранил, 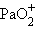 – протактинил. Оксоионы устойчивы и сохраняются без изменения в разнообразных химических реакциях:
– протактинил. Оксоионы устойчивы и сохраняются без изменения в разнообразных химических реакциях:
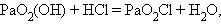
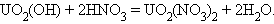
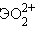 прочность связи увеличивается в ряду Am < Pu < Np.
прочность связи увеличивается в ряду Am < Pu < Np.