

 |
 |
Изменение энтальпии системы не может служить единственным критерием самопроизвольного осуществления химической реакции, поскольку многие эндотермические процессы протекают самопроизвольно. Иллюстрацией этого служит растворение некоторых солей (например, NH4NO3) в воде, сопровождающееся заметным охлаждением раствора. Необходимо учитывать еще один фактор, определяющий способность самопроизвольно переходить из более упорядоченного к менее упорядоченному (более хаотичному) состоянию.
Энтропия (

 |
|
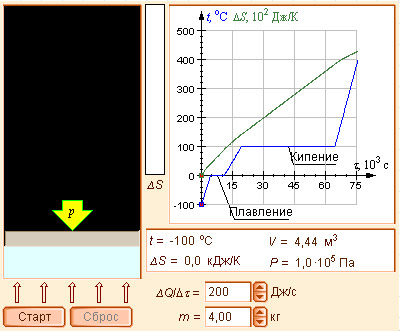
Модель 4.8.
Энтропия и фазовые переходы
|
Л. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы
|
|
Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной
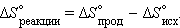 |
*) термин энтропия был введен Клаузиусом (1865 г.) через отношение
Здесь
Энтропия вещества или системы тел при определенной температуре является абсолютной величиной. В табл. 4.1 приведены стандартные энтропии
|
||||||||||||||||||||||||||||||||||||||||||||
| Таблица 4.1 Стандартные энтропии некоторых веществ
|
Из табл. 4.1 следует, что энтропия зависит от:
агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию (вода, лед, пар).
изотопного состава (H2O и D2O).
молекулярной массы однотипных соединений (CH4, C2H6, н-C4H10).
строения молекулы (н-C4H10, изо-C4H10).
кристаллической структуры (аллотропии) – алмаз, графит.
Наконец, рис. 4.3 иллюстрирует зависимость энтропии от температуры.
 |
| Рисунок 4.3 Зависимость энтропии от температуры для свинца: |
Следовательно, стремление системы к беспорядку проявляется тем больше, чем выше температура. Произведение изменения энтропии системы на температуру

 |
|
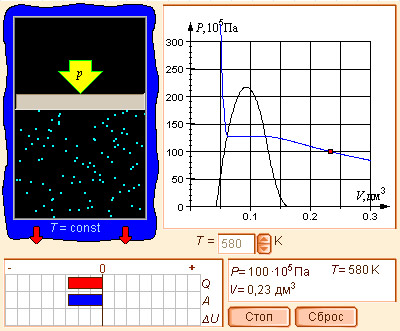
Модель 4.9.
Реальный газ
|
 |
 |
 |

