

 |
 |
Пользуясь табличными значениями 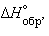
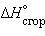 и
и 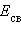 , можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г. И. Гессом (1841 г.): «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».
, можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г. И. Гессом (1841 г.): «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».
Анализ закона Гесса позволяет сформулировать следующие следствия:
Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов.
Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов.
Энтальпия реакции равна разности сумм энергий связей
В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (
Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества.
При определении энтальпии реакции по энергиям связей уравнение реакции пишут с помощью структурных формул для удобства определения числа и характера связей.
Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
Энтальпия гидратации равна разности энтальпий растворения безводной соли 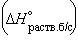 и кристаллогидрата
и кристаллогидрата 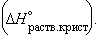
Из вышесказанного видно, что закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям.
Например, диоксид углерода можно получить прямым синтезом из простых веществ (I) или в две стадии через промежуточный продукт (II):
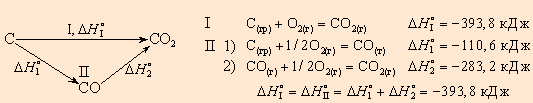 |
| Рисунок 4.1 Энтальпия первого пути равна сумме энтальпий отдельных стадий второго пути
|
Эти термохимические реакции можно представить в виде энтальпийных диаграмм. Естественно, за начало следует принять стандартные состояния простых веществ, энтальпии которых равны нулю. Образование сложных веществ (CO и CO2) сопровождается понижением энтальпии системы.
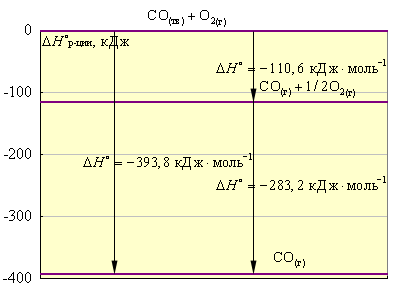 |
| Рисунок 4.2 Энтальпийная диаграмма C + O2 |
 |
 |
 |

