

 |
 |
Стандартная энтальпия образования 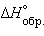 – тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
– тепловой эффект реакции образования одного моля вещества из простых веществ, его составляющих, находящихся в устойчивых стандартных состояниях.
Например, для реакций
| Реакция | Энтальпия образования |
| Na2O(т) + H2O(ж) = 2NaOH(т) | 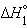 |
| 1/2Na2O(т) + 1/2H2O(ж) = NaOH(т) | 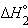 |
| Na(т) + 1/2O2(г) + 1/2H2(г) = NaOH(т) | 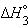 |
| 2Na(т) + O2(г) + H2(г)= 2NaOH(т) | 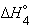 |
только 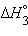 является стандартной энтальпией образования NaOH.
является стандартной энтальпией образования NaOH.
Энтальпия образования простых веществ принята равной нулю, причем нулевое значение энтальпии образования относится к агрегатному состоянию, устойчивому при 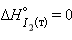 кДж∙
кДж∙ ,
, 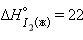 кДж∙
кДж∙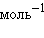 ,
, 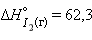 кДж∙
кДж∙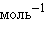 .
.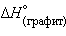 = 0 кДж∙
= 0 кДж∙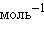 ,
, 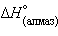 = 1,83 кДж∙
= 1,83 кДж∙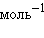 .
.
Стандартная энтальпия сгорания 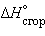 – тепловой эффект реакции сгорания одного моля вещества до образования высших оксидов. Для органических веществ – до
– тепловой эффект реакции сгорания одного моля вещества до образования высших оксидов. Для органических веществ – до 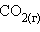 и
и 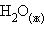 . Теплота сгорания негорючих веществ принимается равной нулю. Теплота сгорания топлива характеризует его теплотворную способность.
. Теплота сгорания негорючих веществ принимается равной нулю. Теплота сгорания топлива характеризует его теплотворную способность.
Энтальпия растворения складывается из теплоты разрушения кристаллической решетки
В зависимости от соотношения значений
Так, энтальпия растворения КОН – отрицательная величина и характеризует экзотермический процесс:
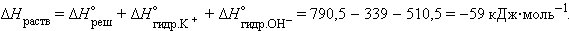 |
Растворение же 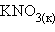 – эндотермический процесс (Δ
– эндотермический процесс (Δ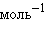 ), так как на разрушение кристаллической решетки
), так как на разрушение кристаллической решетки 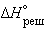 = 684,5 кДж∙
= 684,5 кДж∙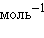 )
)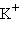 и
и 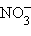 : –339 и
: –339 и

 |
|
Модель 4.7.
Агрегатные состояния
|
Стандартная энтальпия нейтрализации 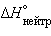 – энтальпия реакции взаимодействия сильных кислот и оснований с образованием одного моля
– энтальпия реакции взаимодействия сильных кислот и оснований с образованием одного моля 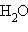 при стандартных условиях.
при стандартных условиях.
| HCl + NaOH = NaCl + H2O; |
|
H+ + OH– = H2O, Δ |
Для концентрированных растворов сильных электролитов 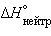 может быть различным из-за изменения значения
может быть различным из-за изменения значения 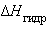 их ионов при разбавлении.
их ионов при разбавлении.
Стандартная энтальпия реакции Δ
|
3H2O(ж) + 2Fe(т) → Fe2O3(т) + 3H2(г), Δ |
Стандартная энтальпия разрыва связи 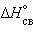 (называемая также энергией связи
(называемая также энергией связи 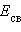 ) – энергия, поглощаемая при разрыве связей двух атомов одного моля вещества, находящегося в газообразном состоянии при 298 К:
) – энергия, поглощаемая при разрыве связей двух атомов одного моля вещества, находящегося в газообразном состоянии при 298 К:
|
HCl(г) → H(г) + Cl(г), Δ |
Средние стандартные энтальпии связи могут быть определены для индивидуального соединения или путем усреднения значений, найденных для целых классов соединений.
 |
 |
 |

