Глава 4. Химическая термодинамика
4.2. Энтальпия
Энтальпия системы (от греч. enthalpo нагреваю) – это однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P, которая связана с внутренней энергией U соотношением
где V – объем системы.
В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:
Энтальпия имеет размерность энергии (кДж). Ее величина пропорциональна количеству вещества; энтальпия единицы количества вещества (моль) измеряется в кДж∙моль–1.
В термодинамической системе выделяющуюся теплоту химического процесса условились считать отрицательной (экзотермический процесс, ΔH < 0), а поглощение системой теплоты соответствует эндотермическому процессу, ΔH > 0.
Уравнения химических реакций с указанием энтальпии процесса называют термохимическими. Численные значения энтальпии ΔH указывают через запятую в кДж и относят ко всей реакции с учетом стехиометрических коэффициентов всех реагирующих веществ. Поскольку реагирующие вещества могут находиться в разных агрегатных состояниях, то оно указывается нижним правым индексом в скобках: (т) – твердое, (к) – кристаллическое, (ж) – жидкое, (г) – газообразное, (р) – растворенное. Например, при взаимодействии газообразных H2 и Cl2 образуются два моля газообразного HCl. Термохимическое уравнение записывается так:
При взаимодействии газообразных H2 и O2 образующаяся H2O может находиться в трех агрегатных состояниях, что скажется на изменении энтальпии:
Приведенные энтальпии образования веществ и энтальпии реакций отнесены к стандартным условиям (P = 101,325 кПа) и взяты для температуры T = 298 K. Стандартное состояние термодинамической функции, например, энтальпии, обозначается нижним и верхним индексами: 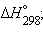 нижний индекс обычно опускают: Δ
нижний индекс обычно опускают: Δ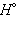 .
.






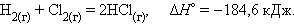
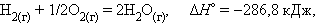
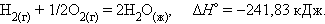
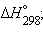 нижний индекс обычно опускают: Δ
нижний индекс обычно опускают: Δ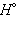 .
.



