

 |
 |
Растворение некоторых веществ сопровождается высвобождением или образованием ионов. При этом возможны диссоциативный и ионизационный механизмы. Диссоциативный механизм превалирует при разрушении ионной кристаллической решетки под воздействием сольватирующего растворителя. Так, ионы, составляющие кристаллическую решетку KCl, приобретают способность проводить электрический ток в любом из двух случаев разрушения кристаллической решетки – под воздействием тепловой энергии (расплав) или под воздействием сольватирующего растворителя (растворение). В последнем случае в раствор переходят готовые ионы, окруженные молекулами растворителя. Процесс взаимодействия ионов кристаллической решетки с молекулами растворителя называется сольватацией.
Ионизационный механизм состоит в том, что в молекулах газообразных, твердых и жидких веществ под воздействием полярных молекул растворителя увеличивается доля ионности настолько, что в раствор могут переходить сольватированные ионы. В зависимости от природы растворителя электролит может быть полностью диссоциирован, либо будет вести себя как слабый электролит:
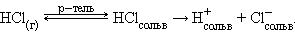 |
В воде равновесие смещено вправо и растворенный хлористый водород диссоциирован полностью. В бензоле растворенный HCl ведет себя как слабый электролит.
Важной характеристикой электролитов служит степень диссоциации α:
|
По величине степени диссоциации электролиты делятся на слабые и сильные. Для сильных электролитов, к которым относятся некоторые минеральные кислоты и щелочи, большинство солей, α > 30 %. К слабым относят некоторые минеральные кислоты (HNO2, HCN, H2SO3), большинство оснований, практически все органические кислоты.

 |
|
Модель 6.5.
Реакция нейтрализации и электропроводность
|
Важнейшей характеристикой слабого электролита служит константа диссоциации.
Рассмотрим равновесную реакцию диссоциации слабого электролита HAn:
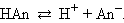 |
Константа равновесия
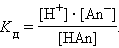 |
Если выразить равновесные концентрации через концентрацию слабого электролита
|
Это соотношение называют законом разбавления Оствальда. Для очень слабых электролитов при
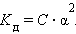 |
Тогда
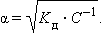 |
Рассмотрим диссоциацию
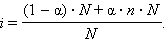 |
Решая его относительно α, получим
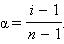 |
Определив экспериментально изотонический коэффициент, можно найти степень диссоциации α в условиях эксперимента.

 |
|
Модель 6.6.
Реакции кислот и оснований
|
Кислоты и основания диссоциируют ступенчато. Каждая ступень диссоциации характеризуется своей константой. Так, трехосновная ортофосфорная кислота H3PO4 диссоциирует следующим образом
|
||||||||||||
| Таблица 6.3 |
Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
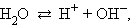 |
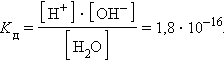 |
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
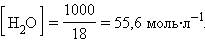 |
Отсюда произведение постоянных величин
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением воды
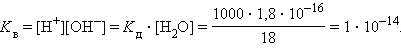 |
Таким образом, в пределах 15–25 °C ионное произведение воды
Равенство [H+] и [OH–] соответствует нейтральной среде [H+] = [OH–] = 1 ∙ 10–7, при [H+] > 1 ∙ 10–7 – кислой, при [H+] < 1 ∙ 10–7 – щелочной.
 |
 |
 |

