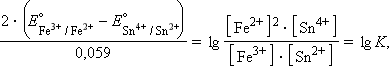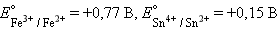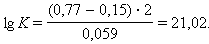Глава 7. Химические источники тока
7.4. Химические источники тока
Каждый гальванический элемент состоит из двух электродов (окислительно-восстановительных пар), один из которых является поставщиком электронов (анод), а другой их принимает (катод). В гальванических элементах источником электрического тока является химическая реакция. Любая химическая реакция термодинамически разрешена, если ΔG < 0. Из соотношений ΔG = –nFE и ΔG° = –nFE° следует, что электрохимическая реакция, а в общем случае любая окислительно-восстановительная реакция может протекать самопроизвольно, если E > 0 или для стандартных условий E° > 0.

 |
|
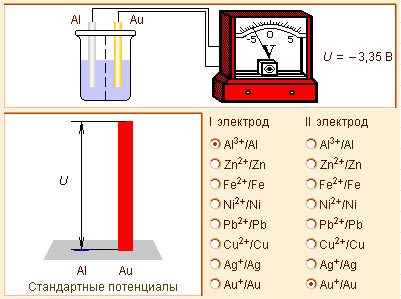
Модель 7.4.
Конструктор гальванических элементов
|
ЭДС гальванического элемента равна разности электродных потенциалов составляющих его электродов. В соответствии с принятой формой записи гальванического элемента его ЭДС равна электродному потенциалу правого электрода (окислителя) минус электродный потенциал левого электрода (восстановителя).
Пользуясь этими соотношениями и таблицей стандартных электродных потенциалов, можно предсказать возможность осуществления многих окислительно-восстановительных реакций.
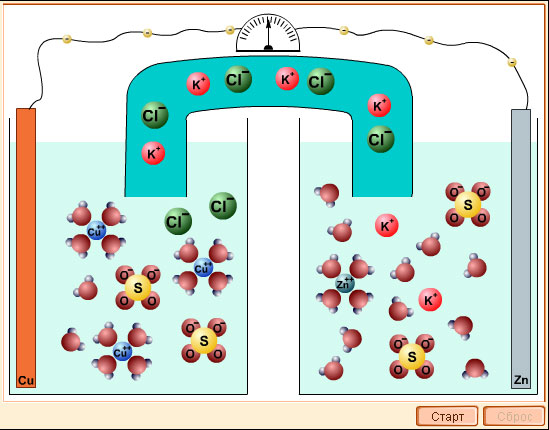
В случае элемента Даниэля–Якоби (–)Zn¦Zn2+||Cu2+¦Cu(+)
Для нестандартных условий ЭДС элемента Даниеля–Якоби находится из разности электродных потенциалов, вычисленных по уравнению Нернста:
Для реакции
осуществляемой в элементе
Величины электродных потенциалов определяются концентрациями (активностями) всех ионов, участвующих в окислительно-восстановительной реакции. Так, в элементе
протекает реакция
и уравнение Нернста для этого элемента имеет вид:
Обратите внимание, что в уравнении Нернста для реакции под знаком логарифма в числителе стоят концентрации исходных веществ, а в знаменателе – продуктов реакции в степенях стехиометрических коэффициентов.

 |
|
Модель 7.5.
Гальванический элемент
|
Итак, сопоставляя электродные потенциалы соответствующих систем, можно заранее определить направление, в котором будет протекать окислительно-восстановительная реакция при любых (нестандартных) условиях. Окисленная форма вещества с более высоким потенциалом является окислителем для восстановленных форм с более низким потенциалом.
Однако в большинстве случаев о направлении реакции можно судить по разности стандартных электродных потенциалов 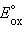 –
– 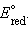 В случае, когда эта разность близка к нулю, для определения направления реакции используют разность не стандартных, а реальных (с учетом активности ионов) потенциалов, вычисленных по уравнению Нернста.
В случае, когда эта разность близка к нулю, для определения направления реакции используют разность не стандартных, а реальных (с учетом активности ионов) потенциалов, вычисленных по уравнению Нернста.
Равновесное состояние любой окислительно-восстановительной реакции характеризуется нулевой ЭДС (ΔGравн = 0). Тогда из уравнения (7.3) следует
то есть представляется возможность определить константу равновесия из электрохимических данных.
При
Следовательно, реакция 2Fe3+ + Sn2+ = 2Fe2+ + Sn4+ будет самопроизвольно протекать слева направо, поскольку константа равновесия ее очень велика (K = 1 · 1021).
В общем виде связь ЭДС с K выражается уравнением









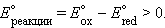
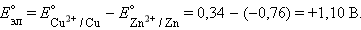
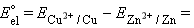
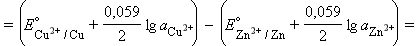
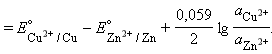
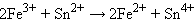
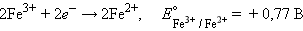
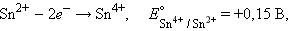
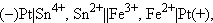
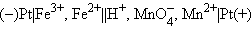
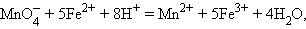
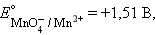
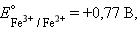
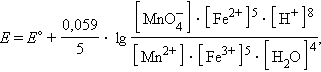
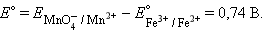


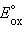 –
– 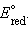 В случае, когда эта разность близка к нулю, для определения направления реакции используют разность не стандартных, а реальных (с учетом активности ионов) потенциалов, вычисленных по уравнению Нернста.
В случае, когда эта разность близка к нулю, для определения направления реакции используют разность не стандартных, а реальных (с учетом активности ионов) потенциалов, вычисленных по уравнению Нернста.