

 |
 |
В основе коррозийных процессов лежат окислительно-восстановительные реакции металлов с окружающей средой, сопровождающиеся переходом металлов в более термодинамически устойчивое состояние.
Рассмотрим коррозию железа как электрохимический процесс. Ржавление железа есть не что иное, как анодная реакция
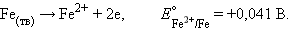 |
Катодная реакция – восстановление атмосферного кислорода:
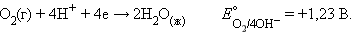 |
Водородные ионы поставляет вода. Если бы в воде не было растворенного кислорода, то коррозия была бы невозможна. Следовательно, железо корродирует в слое воды, насыщенном кислородом. Таким образом, начальную стадию коррозии железа можно передать реакцией
| 2Fe + O2 + 4H+ → 2FeO + 2H2O. |
На скорость коррозии существенное влияние оказывает концентрация ионов H+. Повышение pH приводит к замедлению коррозии, поскольку восстановление O2 из H2O замедляется. При
|
4Fe2+ + O2 + 4H2O + |
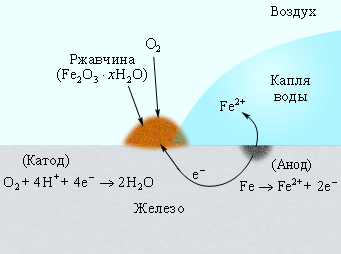 |
| Рисунок 7.4 Коррозия железа кислородом воздуха, растворенным в воде
|
Для защиты железа от коррозии используются всевозможные покрытия: краска, слой металла (олова, цинка). При этом краска и олово предохраняют от коррозии до тех пор, пока защитный слой цел. Появление в нем трещин и царапин способствует проникновению влаги и воздуха к поверхности железа, и процесс коррозии возобновляется, причем в случае оловянного покрытия он даже ускоряется, поскольку олово служит катодом в электрохимическом процессе (рис. 7.5).
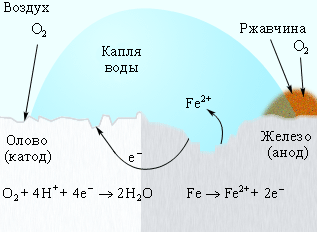 |
| Рисунок 7.5 Коррозия «белой жести» |
Оцинкованное железо ведет себя иначе. Поскольку цинк выполняет роль анода, то его защитная функция сохраняется и при нарушении цинкового покрытия (рис. 7.6).
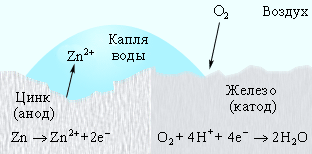 |
| Рисунок 7.6 Катодная защита в оцинкованном железе
|
Катодная защита широко используется для уменьшения коррозии подземных и подводных трубопроводов и стальных опор высоковольтных передач, нефтяных платформ и причалов.
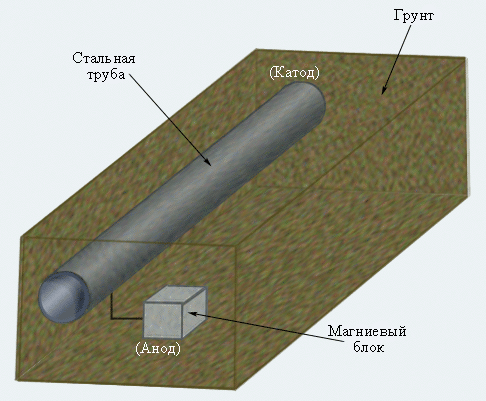 |
| Рисунок 7.7 Катодная защита подземного трубопровода
|
 |
 |
 |

