

 |
 |
Металлы характеризуются склонностью сплавляться друг с другом, образуя твердые растворы и химические соединения, называемые интерметаллическими, или интерметаллидами.
В противоположность твердым растворам интерметаллиды имеют кристаллическую структуру, отличную от структур исходных металлов. Состав интерметаллических соединений не всегда подчиняется правилам валентности, но эти соединения имеют ярко выраженную индивидуальность свойств. Два металла могут образовывать между собой не одно, а несколько соединений, например, NaSn3, NaSn2, NaSn, Na4Sn3, Na2Sn, Na4Sn и др., существующие лишь в определенных пределах состава и температуры.
Устойчивость интерметаллидов определяется природой взаимодействующих металлов. Чем сильнее отличаются металлы по своей природе и электроотрицательности (ЭО), тем более прочные соединения они образуют, а их образование сопровождается значительным экзотермическим эффектом. Эту закономерность можно наблюдать на примере соединений Mg с металлами II–V групп, в которых 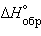 резко повышается при переходе от MgZn к
резко повышается при переходе от MgZn к 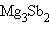 (табл. 8.7).
(табл. 8.7).
|
||||||||||||
| Таблица 8.7 Интерметаллиды магния
|
Среди соединений различают два типа: валентные и электронные.
Валентные интерметаллиды, как правило, образуют металлы с заметно отличающимися электроотрицательностями. Диаграммы плавкости в этом случае имеют четко выраженный максимум, соответствующий составу интерметаллида. Формула последнего отвечает обычным валентностям элементов (Na2Sn, Na4Sn, Mg2Ge, Mg2Sn, Mg3Sb2, Mg3Al2. Связь в таких соединениях ковалентно-полярная, растет с уменьшением ΔОЭО атомов. При электролизе расплавов валентных интерметаллидов на аноде осаждается более электроотрицательный металл.
Типичные металлы образуют второй тип интерметаллидов – электронные соединения. В них элементы не проявляют своих характерных степеней окисления. Их состав определяется не свойствами взаимодействующих компонентов, а формальной электронной концентрацией (ФЭК), т. е. отношением числа валентных электронов к числу взаимодействующих атомов в формуле. В соответствии со значениями ФЭК (табл. 8.8) большинство известных электронных соединений можно отнести к трем типам со свойственными им кристаллическими решетками. Для первого типа ФЭК равна 3/2, для второго – 21/13, третьего – 7/4.
|
||||||||||||||||||||||||||||||||
| Таблица 8.8 Интерметаллиды электронного типа
|
 |
 |
 |

