

 |
 |
Благородные газы имеют электронную конфигурацию
Молекула благородного газа 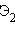 существовать не может –
существовать не может – 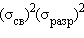 . Но если удалить один электрон, то заполнение верхней разрыхляющей орбитали лишь наполовину –
. Но если удалить один электрон, то заполнение верхней разрыхляющей орбитали лишь наполовину – 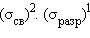 является – энергетической основой существования молекулярных ионов благородных газов
является – энергетической основой существования молекулярных ионов благородных газов 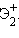
|
||||||||||||||||||||||||||||||||||||||||||
| Таблица 8.9 Некоторые характеристики элементов VIIIА подгруппы
|
Соединения включения, или клатраты, известны только в твердом состоянии. Например, гидраты типа Э∙6H2O образуются при действии сжатых благородных газов на кристаллизующуюся переохлажденную воду и существуют в кристаллической решетке льда при низких температурах и повышенных давлениях. В ряду Ar–Rn давление газа над кристаллогидратами при 0 °С падает с 98 атм до 0,4 атм, что обусловлено оптимизацией соотношения размеров атома и занимаемой им полости в структуре льда, а также различием в поляризуемости атомов, и указывает на большую прочность гидратов тяжелых газов. Клатратные соединения используют для разделения и хранения благородных газов.
Соединения с валентными связями Э (II), Э (IV), Э (VI), Э (VIII) хорошо изучены на примере фторидов Kr и Xe, полученных по схеме
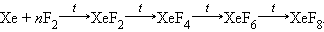 |
Химическая связь в соединениях благородных газов не может быть описана с позиций МВС, поскольку в соответствии с этим методом в образовании связи должны участвовать
В рамках ММО строение XeF2 объясняется схемой, в которой
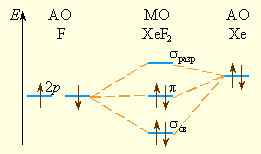 |
| Рисунок 8.9 |
Тетрафторид ксенона является сильным окислителем:
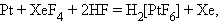 |
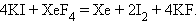 |
При нагревании и гидролизе XeF4 диспропорционирует:
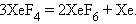 |
Для шестивалентного Xe известны фторид XeF6, оксид XeO3, XeOF4 – оксофторид, Xe(OH)6 – гидроксид, а также комплексные ионы типа 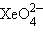 и
и 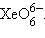
XeO3 хорошо растворим в воде и образует сильную кислоту
 |
Гексафторид очень активен, реагирует с кварцем:
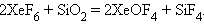 |
Производные Xe (VI) – сильные окислители, например:
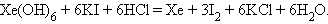 |
Для Xe (VIII) известны, кроме того, XeF8, XeO4, XeOF6, 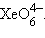
В обычных условиях XeO4 медленно разлагается:
|
По мере увеличения степени окисления ксенона устойчивость бинарных и солеподобных соединений падает, а анионных комплексов – возрастает.
Для криптона получены лишь KrF2, KrF4, неустойчивая криптоновая кислота KrO3∙H2O и ее соль BaKrO4.
 |
| Рисунок 8.10 Инертные газы используются как наполнители газоразрядных ламп
|
Гелий используется в низкотемпературных процессах для создания инертной атмосферы в лабораторных аппаратах, при сварке и в газонаполненных электрических лампах, неон – в газоразрядных трубках, аргон – для создания инертной атмосферы в химическом синтезе и сварочных работах.
Соединения благородных газов используются в качестве сильных окислителей. В виде фторидов ксенона хранят фтор и ксенон.
 |
 |
 |

