Глава 8. Химические свойства элементов
8.3. d-Элементы
К d-элементам относят те элементы, атомы которых содержат валентные электроны на (n – 1)d ns-уровнях и составляют побочные (IIIВ–VIIВ, IВ, IIВ) подгруппы, занимая промежуточное положение между типичными s-металлами (IА, IIА) и p-элементами. Из 109 элементов периодической системы 37 относятся к d-элементам; из них последние 7 радиоактивны и входят в незавершенный седьмой период. Электронное строение атомов d-элементов определяет их химические свойства. 3d-Элементы по химическим свойствам существенно отличаются от 4d- и 5d-элементов. При этом элементы IVВ–VIIВ подгрупп очень схожи по многим химическим свойствам. Это сходство обусловлено лантаноидным сжатием, которое из-за монотонного уменьшения радиусов при заполнении 4f-орбиталей приводит к практическому совпадению радиусов циркония и гафния, ниобия и тантала, молибдена и вольфрама, технеция и рения. Элементы этих пар очень близки по физическим и особенно по химическим свойствам; первые шесть элементов встречаются в одних рудных месторождениях, трудно разделяются; их иногда называют элементами-близнецами.
Атомы d-элементов характеризуются общей электронной формулой (n – 1)d1–10ns0–2. Некоторые из тяжелых d-элементов не являются полными электронными аналогами. В табл. 8.10 приведены электронные формулы всех d-элементов и возможные степени окисления, проявляемые ими. Увеличение числа электронов иногда сопровождается немонотонностью заселения d-орбиталей. Это обусловлено сближением энергий (n – 1)d- и ns-орбиталей и усилением межэлектронного взаимодействия к концу периода.
| Группы и электронные формулы 3d–6d-элементов, характерные степени окисления |
| IIIB |
IVB |
VB |
VIB |
VIIB |
VIIIB |
IB |
IIB |
Sc
3d14s2
3 |
Ti
3d24s2
2, 3, 4 |
V
3d34s2
2, 3, 4, 5 |
Cr
3d54s1
1, 2, 3, 4, 5, 6 |
Mn
3d54s2
2, 3, 4, 5, 6, 7 |
Fe
3d64s2
2, 3, 4, 5, 6 |
Co
3d74s2
2, 3, 4 |
Ni
3d84s2
2, 3, 4 |
Cu
3d104s1
1, 2, 3 |
Zn
3d104s2
2 |
Y
4d15s2
3 |
Zr
4d25s2
3, 4 |
Nb
4d45s1
3, 4, 5 |
Mo
4d55s1
2, 3, 4, 5, 6 |
Tc
4d55s2
2, 3, 4, 5, 6, 7 |
Ru
4d75s1
1–8 |
Rh
4d85s1
1–6 |
Pd
4d105s0
2–5 |
Ag
4d105s1
1, 2 |
Cd
4d105s2
2 |
La
5d16s2
3 |
Hf
5d26s2
3, 4 |
Ta
5d36s2
3, 4, 5 |
W
5d46s2
– |
Re
5d56s2
2, 3, 4, 5, 6, 7 |
Os
5d66s2
1–8 |
Ir
5d76s2
1–6 |
Pt
5d96s1
2–6 |
Au
5d106s1
1, 3, 5 |
Hg
5d106s2
1, 2 |
Ac
6d17s2
3 |
Rf
6d27s2
– |
Db
6d37s2
– |
Sg
6d47s2
– |
Bh
6d57s2
– |
Hn
6d67s2
– |
Mt
6d77s2
– |
– |
– |
– |
|
| Таблица 8.10 Электронные формулы и типичные степени окисления d-элементов.
|
По мере увеличения числа d-электронов в периоде они могут переходить с одного уровня на другой для достижения требуемой правилами Гунда одной из наиболее устойчивых конфигураций (d5, d10). Такие переходы реализуются, например, в случае Cr(3d54s1), Cu(3d104s1), Mo(4d55s1), Ag(4d105s1). Обращает на себя внимание тот факт, что в одной подгруппе существуют элементы с разными электронными конфигурациями, например: V(3d34s2), Nb(4d45s1) и Ta(5d36s2); Ni(3d84s2), Pd(4d105s0) и Pt(5d96s1). Палладий является единственным d-элементом с незаполненным s-уровнем.
d-Элементы обладают некоторыми особенностями по сравнению с элементами главных подгрупп.
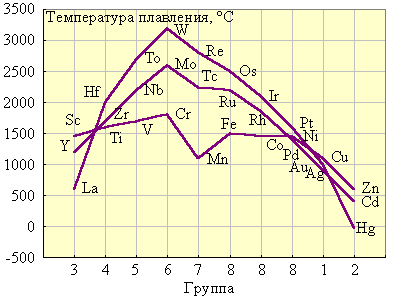
1. У d-элементов лишь небольшая часть валентных электронов делокализована по всему кристаллу (тогда как у щелочных и щелочноземельных металлов валентные электроны полностью отданы в коллективное пользование). Остальные d-электроны участвуют в образовании направленных ковалентных связей между соседними атомами. Таким образом, эти элементы в кристаллическом состоянии обладают не чисто металлической связью, а ковалентно-металлической. Поэтому все они твердые (кроме Hg) и тугоплавкие (за исключением Zn, Cd) металлы (рис. 8.11).
 1 1
|
| Рисунок 8.11 Температура плавления d-элементов
|
Из рис. 8.11. видно, что наиболее тугоплавки металлы VВ и VIВ подгрупп. У них заполняется электронами половина d-подуровня и реализуется максимально возможное число неспаренных электронов, а следовательно, наибольшее число ковалентных связей. Дальнейшее заполнение приводит к уменьшению числа ковалентных связей и падению температур плавления.
2. Вследствие незаполненности d-оболочек и наличия близких по энергии незаполненных ns- и np-уровней, d-элементы склонны к комплексообразованию; их комплексные соединения, как правило, окрашены и парамагнитны.
3. d-Элементы чаще, чем элементы главных подгрупп, образуют соединения переменного состава (оксиды, гидриды, карбиды, силициды, нитриды, бориды). Кроме того, они образуют сплавы между собой и с другими металлами, а также интерметаллические соединения.
4. Для d-элементов характерен большой набор валентных состояний (табл. 8.10) и, как следствие этого, изменение кислотно-основных и окислительно-восстановительных свойств в широких пределах.
Поскольку часть валентных электронов находится на s-орбиталях, то проявляемые ими низшие степени окисления как правило равны двум. Исключение составляют элементы, ионы которых Э+3 и Э+ имеют устойчивые конфигурации d0, d5 и d10: Sc3+, Fe3+, Cr+, Cu+, Ag+, Au+.
Соединения, в которых d-элементы находятся в низшей степени окисления, образуют кристаллы ионного типа, в химических реакциях проявляют основные свойства и являются, как правило, восстановителями.
Устойчивость соединений, в которых d-элементы находятся в высшей степени окисления (равной номеру группы),увеличивается в пределах каждого переходного ряда слева направо, достигая максимума для 3d-элементов у Mn, а во втором и третьем переходных рядах – у Ru и Os соответственно. В пределах одной подгруппы стабильность соединений высшей степени окисления уменьшается в ряду 5d > 4d > 3d, о чем свидетельствует характер изменения энергии Гиббса (изобарно-изотермического потенциала) однотипных соединений, например:
 кДж∙моль–1 кДж∙моль–1 |
CrO3 |
MoO3 |
WO3 |
Mn2O7 |
Tc2O7 |
Re2O7 |
| –506 |
–677 |
–763 |
–543,4 |
–936,3 |
–1165 |
|
| Таблица 8.11 Энтальпии образования высших оксидов VIB и VIIB подгрупп
|
Это явление связано с тем, что при увеличении главного квантового числа в пределах одной подгруппы происходит уменьшение разности энергий (n – 1)d- и ns-подуровней. Этим соединениям свойственны ковалентно-полярные связи. Они имеют кислотный характер и являются окислителями (CrO3 и K2CrO4, Mn2O7 и KMnO4).
Соединения, в которых d-электроны находятся в промежуточных степенях окисления, проявляют амфотерные свойства и окислительно-восстановительную двойственность.
5. Сходство d-элементов с элементами главных подгрупп Э(0) в полной мере проявляется у элементов третьей группы ns2np1 и (n – 1)d1ns2. С возрастанием номера группы оно уменьшается; элементы VIIIА подгруппы – газы, VIIIВ – металлы. В первой группе снова появляется отдаленное сходство (все элементы – металлы), а элементы IВ подгруппы – хорошие проводники; это сходство усиливается во второй группе, так как d-элементы Zn, Cd и Hg не участвуют в образовании химической связи.
6. d-элементы IIIВ–VIIВ подгрупп в высших степенях окисления по свойствам подобны соответствующим p-элементам. Так, в высших степенях окисления Mn (VII) и Cl (VII) являются электронными аналогами. Подобие электронных конфигураций (s2p6) приводит к подобию свойств соединений семивалентных марганца и хлора. Mn2O7 и Cl2O7 в обычных условиях малоустойчивые жидкости, являющиеся ангидридами сильных кислот с общей формулой НЭО4. В низших степенях окисления марганец и хлор имеют различное электронное строение, что обусловливает резкое отличие свойств их соединений. Например, низший оксид хлора Cl2O (s2p4) – газообразное вещество, являющееся ангидридом хлорноватистой кислоты (HClO), тогда как низший оксид марганца MnO (d5) представляет собой твердое кристаллическое вещество основного характера.
 2 2
|
| Рисунок 8.12 Сульфиды свинца (галенит или свинцовый блеск), ртути (киноварь), железа (пирит или железный колчедан), цинка (бленда)
|
7. Как известно, восстановительная способность металла определяется не только его энергией ионизации (М – ne– → Мn+; +∆Hиониз), но и энтальпией гидратации образовавшегося катиона (Мn+ + mH2O → Мn+·mH2O; –∆Hгидр). Энергии ионизации d-элементов в сравнении с другими металлами велики, но они компенсируются большими энтальпиями гидратации их ионов. Вследствие этого электродные потенциалы большинства d-элементов отрицательны.
В периоде с ростом Z восстановительные свойства металлов уменьшаются, достигая минимума у элементов IВ группы. Тяжелые металлы VIIIВ и IВ групп за свою инертность названы благородными.
Окислительно-восстановительные тенденции соединений d-элементов определяются изменением устойчивости высших и низших степеней окисления в зависимости от положения их в периодической системе. Соединения с максимальной степенью окисления элемента проявляют исключительно окислительные свойства, а с низшей – восстановительные. Mn(OH)2 легко окисляется на воздухе Mn(OH)2 + 1/2O2 = MnO2 + H2O. Соединения Mn(IV) легко восстанавливаются до Mn (II): MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O, но сильными окислителями окисляется до Mn (VII). Перманганат-ион MnO4– может быть только окислителем.
Поскольку для d-элементов в пределах подгруппы устойчивость высших степеней окисления сверху вниз растет, то окислительные свойства соединений высшей степени окисления резко падают. Так, соединения хрома (VI) (CrO3, K2CrO4, K2Cr2O7) и марганца(VII) (Mn2O7, KMnO4) – сильные окислители, а WO3, Re2O7 и соли соответствующих им кислот (H2WO4, HReO4) восстанавливаются с трудом.
8. На кислотно-основные свойства гидроксидов d-элементов влияют те же факторы (величина ионного радиуса и заряд иона), что и на гидроксиды p-элементов.
Гидроксиды низших степеней окисления d-элементов обычно проявляют основные свойства, а отвечающие высшим степеням окисления – кислотные. В промежуточных степенях окисления гидроксиды амфотерны. Особенно отчетливо изменение кислотно-основных свойств гидроксидов при изменении степени окисления проявляется в соединенинях марганца. В ряду Mn(OH)2 – Mn(OH)3 – Mn(OH)4 – H2MnO4 – HMnO4 свойства гидроксидов меняются от слабого основания Mn(OH)2 через амфотерные Mn(OH)3 и Mn(OH)4 к сильным кислотам H2MnO4 и HMnO4.
В пределах одной подгруппы гидроксиды d-элементов одинаковой степени окисления характеризуются увеличением основных свойств при движении сверху вниз. Например, в IIIВ группе Sc(OH)3 – слабое, а La(OH)3 – сильное основание. Элементы IVВ группы Ti, Zn, Hf образуют амфотерные гидроксиды Э(OH)4, но кислотные свойства их ослабевают при переходе от Ti к Hf.
 3 3
|
| Рисунок 8.13 Бериллий
|
9. Отличительной особенностью переходных элементов является образование фаз переменного состава. Это, во-первых, твердые растворы внедрения и замещения и, во-вторых, соединения переменного состава. Твердые растворы образуются элементами с близкими электроотрицательностями, атомными радиусами и одинаковыми кристаллическими решетками. Чем больше отличаются элементы по своей природе, тем менее они растворяются друг в друге и тем более склонны к образованию химических соединений. Такие соединения могут иметь как постоянный, так и переменный состав. В отличие от твердых растворов, в которых сохраняется решетка одного из компонентов, для соединений характерно образование новой решетки и новых химических связей. Другими словами, к химическим соединениям относят лишь те фазы переменного состава, которые резко отличаются по строению и свойствам от исходных.
Для соединений переменного состава характерны следующие особенности:
а) Состав этих соединений зависит от способа получения. Так, в зависимости от условий синтеза оксиды титана имеют состав TiO1,2–1,5 и TiO1,9–2,0; карбиды титана и ванадия – TiC0,6–1,0 и VС0,58–1,09, нитрид титана TiN0,45–1,00.
б) Соединения сохраняют свою кристаллическую решетку при значительных колебаниях количественного состава, то есть имеют широкую область гомогенности. Так, TiC0,6–1,0, как следует из формулы, сохраняет решетку карбида титана при недостатке в ней до 40 % атомов углерода.
в) Природа связи в таких соединениях определяется степенью заполнения d-орбиталей металла. Электроны внедренного неметалла заселяют вакантные d-орбитали, что приводит к усилению ковалентности связей. Именно поэтому доля металлической связи в соединениях начальных элементов d-рядов (IV–V групп) понижена.
Наличие ковалентной связи в них подтверждается большими положительными энтальпиями образования соединений, более высокими твердостью и температурой плавления, меньшей электропроводностью по сравнению с образующими их металлами.













